Megkezdődött az emberi DNS módosítása

1997-ben mutatták be a Gattaca című utópisztikus sci-fi filmet, amely egy olyan jövőt vázol fel, ahol a mesterséges megtermékenyítésé a főszerep, hogy a lehető legjobb genetikai tulajdonságú zigótákból fejlődjenek ki végül
a lehető legjobb genetikai tulajdonságú gyerekek.
A film által bemutatott társadalomban az embereket genetikai szűrés alapján választják ki bizonyos munkákra – akik nem felelnek meg a felállított kritériumoknak, azok csak alsóbbrendű, egyszerűbb munkákat végezhetnek. Kizárólag a genetikai tulajdonságok számítanak, és már akkor eldől az egyén sorsa, amikor megszületik.
Az alábbiakban a Gattaca című filmből láthat részleteket:
A film megjelenésekor ez a fajta kiválasztás, a genetikai szűrések és a DNS-módosítás még mind távoli jövőnek, sőt, talán az ehhez hasonló mozikra szorítkozó elképzelt történetnek tűnt. A Vissza a jövőbe zsugorodó kabátjával és légdeszkájával ellentétben azonban ezek a technológiák vagy legalábbis az ezekre rávezető módszerek ma már léteznek, és ezeket használják is úttörő kutatók.
Most éppen az Egyesült Királyságban indul majd meg az emberi embrió génszerkezetének módosítása.
Az angol HFEA (Human Fertilisation and Embryology Authority, azaz Emberi Megtermékenyítési és Fejlődéstani Hatóság) február elsején engedélyezte, hogy a Francis Crick Intézet kutatója, Kathy Niakan és csoportja emberi embriókon kísérletezzen egy új génszerkesztési módszer, a CRISPR/Cas9 használatával.
Ez így elég ijesztőnek hangzik, de meg kell jegyezni:
a kutatásokat szigorú szabályozásokhoz kötötték,
az embriók nem lehetnek hétnaposnál idősebbek, és a tényleges munka megkezdése előtt még egy független etikai bizottságnak is engedélyt kell adnia az egész tervre. A HFEA csak e feltételek teljesülése esetén adja áldását a kutatásokra.
Az emberi gének módosítása világszerte igencsak ingoványos terület: Magyarországon, Németországban és Olaszországban szigorúan tilos az ilyen eljárás, az Egyesült Államokban pedig magánúton elvileg szabad, csak állami támogatással nem – egyelőre azonban
senki nem verte nagydobra, hogy belenyúlni készül az emberi DNS szerkezetébe.
Kínában azonban kicsit más a helyzet: már korábban is pletykálták, hogy egyes intézetek kísérleteznek a génmódosítással, tavaly azonban be is bizonyosodott, hogy helyi kutatók megsemmisítésre váró emberi embriók génszerkezetébe nyúltak bele: a Szun Jat-szen Egyetem genetikusa, Huang Csün-csiu és csapata 86 embrió DNS-szerkezetét piszkálta meg.

A kutatók egy potenciálisan halálos vérbetegség, a béta-thalassemia kialakulásáért felelős gént próbálták módosítani a 86 embrión, azonban csupán 28 esetben jártak sikerrel, ami
az összes kísérlet alig 30 százalékát jelenti.
A Protein and Cell tudományos folyóiratban megjelent tanulmány rámutat arra, hogy ez az etikailag kifogásolható kísérletsorozat fontos mérföldkő, de egyben tanmese is, hiszen a kutatás olyan akadályokra világított rá, amelyek gátolják a módszer orvosi alkalmazását.
A megfelelő engedélyek a kínai tudósoknak sem álltak rendelkezésre, így a brit döntés valóban egyedülállónak számít a szakmában. „A génmódosítás más fajtáit klinikai célokra már több helyen használják. Például épp a napokban hagyták jóvá, hogy az Egyesült Államokban
létrehozzanak olyan embriókat, amelyek genetikai anyaga három szülőtől származzon
– azaz a sejt energiatermelő mitokondriumai, amelyek normális esetben az anyától származnak, egy másik nő petesejtjéből érkezzenek” – mondta el az Origónak Varga Máté, az ELTE genetikai tanszékének adjunktusa. Ennek az eljárásnak annyi köze van a DNS-szerkesztéshez, hogy szintén a DNS-be kódolt betegségeket hivatott kiküszöbölni – a Nature weboldala szerint az elsődleges szempont az, hogy az anyák ne adhassák tovább a mitokondriális DNS-ükkel örökletes betegségeiket, ehhez kell a harmadik fél, aki nem hordozza a mutációt.

A Francis Crick Intézet kutatóinak munkája is a különböző betegségeket, valamint a meddőséget és a korai vetélés problémáját igyekszik kiküszöbölni. A kísérletek segíthetik a lombikbébi-program sikerességét, mivel az embrióképződés legkorábbi szakaszát vizsgálják: az elsőtől a hetedik napig tartó időszakot, amikor a zigótából hólyagcsíra lesz. A kutatás eredményeként
megérthetjük majd, hogyan fejlődik az emberi embrió a fogantatás korai szakaszában
– még mindig vannak ugyanis olyan fehér foltok, amelyeket a modern kutatási módszerekkel sem sikerül megmagyarázni.

Ilyen például, hogy az első néhány napban a sejtosztódás során mi alapján válnak szét a sejtek méhlepénnyé, magzatburokká vagy magává az embrióvá, egyelőre ugyanis nem tudjuk, mi irányítja ezt a folyamatot.
Hogyan fejlődik egy embrió?
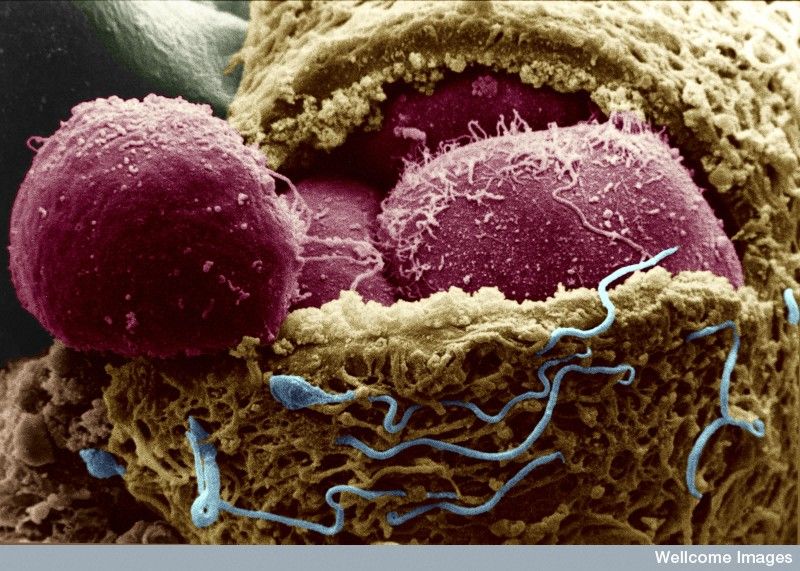
A petesejt és hímivarsejt találkozása után alig 24 óra alatt végbemegy a megtermékenyítés folyamata, és kialakul az egyetlen sejtből álló zigóta. A zigóta az első-második napon osztódásnak indul (ezt barázdálódásnak nevezzük), és megkezdi útját a méhüreg felé. Az ekkor létrejövő, összefüggő és azonos tulajdonságú sejtekből álló sejthalmazt nevezzük előébrénynek. Ez a 2-3. napon nyolc, a 3-5. napon 16 sejtből áll, utóbbinak speciális neve a szedercsíra (morula). A szedercsíra a 3-4. napon érkezik meg a méhbe, ahol a további sejtosztódás hatására létrejön a 4-6. napon a hólyagcsíra (blasztociszta). Nevét onnan kapta, hogy belsejében található egy sejtmentes üreg, amelynek falához tapadnak az embriócsomót alkotó sejtek.A kutatóknak az első hét nap után meg kell majd semmisíteniük a hólyagcsíra-állapotban lévő embriókat, és kitétel, hogy szigorúan tilos ezeket a génmódosított embriókat beültetni és tovább „nevelni”. A génszerkesztésnek egyelőre kizárólag klinikai megoldását engedélyezték, de ez persze
nem jelenti azt, hogy később ne lehetne gyakorlati alkalmazásokra is gondolni.
„Potenciális felhasználásként említhetjük az egyetlen gén működésképtelenségén múló betegségek kiküszöbölését, amelyek súlyos következményekkel, adott esetben nagyon korai halállal járnak” –magyarázta az Origónak Varga Máté.
„Igaz, ezen betegségek ellen genetikai szűrésekkel is küzdhetünk, de előfordulhat, hogy a szülők mindketten maguk is csak az adott gén hibás változatait hordozzák, és ilyenkor a génszerkesztésen kívül nincs is esélyük arra, hogy biológiai gyermekük egészséges legyen.”
Persze ahogy a kínai génszerkesztési kutatások, a brit engedély is rengeteg etikai kérdést vet fel, és az eljárást ellenzők rögtön hangot adtak véleményüknek. A tudósok nagy része értetlenül nézi, hogy
mekkora ellentábor állt fel az óvatos kísérletekkel szemben,
hiszen a most engedélyezett kutatás is szigorú szabályozások alatt folyik majd, és egyelőre szó sincs arról, hogy egy génmódosított embrióból élő gyermeket neveljenek.
„Tulajdonképpen a romantika óta megfigyelhető az európai gondolkodásban egyfajta ódzkodás a mesterséges dolgoktól és vágyódás a természetes területek felé” – fejtegette Varga Máté. – „Ez persze egy érzelmi viszonyulás, igazából racionális alapja nincs, hiszen bár természetesen vannak rossz „mesterséges” és jó „természetes” dolgok, ellenkező irányban is találhatunk példákat:
a légyölő galóca mérge természetes, és mégis rossz, a ma kapható inzulin pedig szintetikus, és mégis jó.
A 21. században valóban egyre inkább megfigyelhető a mesterséges termékekkel szembeni ódzkodás, elég, ha arra gondolunk, mennyien ellenzik a védőoltásokat (sokszor visszafordíthatatlan károkat okozva ezzel gyermekük egészségében), és arra, hogy mennyire könnyen tör előre a mindenféle tudományos alapot nélkülöző homeopátia.

„Ez a fajta, racionalitást mellőző megközelítés vezetett oda, hogy ma nagyon sokan ab ovo károsnak tekintik a biotechnológia szinte bármilyen megnyilvánulását. Annak, hogy Magyarországon ennyire szélsőséges a közvélemény, részben politikai okai vannak, részben pedig a média okolható a jelenségért: az újságok mindig jobb sztorinak tartották, hogy egyesek szerint milyen elborzasztó dolgok történhetnek a génmódosítás eredményeként, és lusták voltak egyenként, kritikusan megvizsgálni ezeket az állításokat” – mondta az Origónak nyilatkozó kutató.
Persze a másik oldalt is könnyű megérteni: ha ezek a kísérletek kikerülnek a szigorú szabályozó korlátozások alól, valóban semmi nem véd meg bennünket attól, hogy a dizájnerbabák korszakába lépjünk. Hatalmas üzleti lehetőségek lehetnek abban, hogy egy szülő megtervezheti gyermeke nemét, szemének színét, azt, hogy milyen magas lesz, vagy, hogy milyen árnyalatú legyen a haja. Itt jön képbe a Gattaca-féle jövőkép is: ha már ezeket a tulajdonságokat képesek leszünk előre meghatározni, vajon megállunk-e ennél, vagy
továbbmegyünk, és a genetikailag tökéletes egyedekre koncentrálunk majd?
Lesznek erős, izmos, ellenálló szuperkatonák, vagy képesek leszünk legyőzni az öregedést? Nevelünk majd előre meghatározott életcélra gyerekeket? Úgy születnek majd a babák, hogy a szülők már előre megmondhatják: orvos legyen a gyerekből, vagy űrhajós, esetleg ügyvéd?
A határ valóban a csillagos ég – azonban még egyáltalán nem tartunk itt, és könnyen lehet, hogy soha nem is fogunk.
„Ha pusztán azt nézzük, hogy a dizájnerbébik feltétele – egy megengedő etikai szabályozás mellett, ami se nem triviális, se nem valószínű – a genom szerkesztése, akkor akár azt is mondhatjuk, hogy igen, közelebb léphetünk a Gattaca-féle világképhez” – mondta Varga Máté. – „De hiába ez az általánosan legnagyobb félelem,
a jelenlegi technológiával és ismereteinkkel valójában nem tűnik kivitelezhetőnek,
hiszen azok a komplex tulajdonságok, amelyek itt szóba kerülhetnek (például az intelligencia, de akár a testmagasság is) annyira bonyolult genetikai szabályozásúak, hogy ma sem értjük őket, tehát nem is tudjuk, hogy melyik géneket miként kellene megváltoztatni.”

Babacipőben járunk tehát az ilyen specifikus tulajdonságok megalkotásában, és egyelőre az orvostudomány nem is ezek, hanem a veszélyes és végzetes betegségek kiküszöbölése felé fordul.
Azt azonban egyáltalán nem mondhatjuk, hogy veszélytelenek ezek a beavatkozások – a most felvázolt szabályozási keretek között a génszerkesztésre vállalkozó kutatócsoportok nagy bajt nem csinálhatnak, de ha eljutunk odáig, hogy megszületik az első génmódosított baba, már jó néhány dolog félrecsúszhat –,
akár akaratlanul más tulajdonságokat is megváltoztathatunk.
„Ha egy hibás gént javítunk ki, az egyetlen veszély, ami szóba jöhet, az, hogy valahol máshol is beleírunk a genomba. A ma használt nukleázoknak azonban elég nagy a pontosságuk, olyannyira, hogy a saját sejtjeink osztódása során a DNS-másoló mechanizmusok hibája több mutációt okozhat, mint ez az említett téves beleírás” – fejtette ki Varga Máté.
A jelenlegi ismereteink szerint tehát a természetes mutáció több betegséget és deformitást hoz létre, mint amennyit mi a pontos módszerek segítségével előidézhetünk – mégis, sokkal ijesztőbb, ha mesterséges beavatkozás közben romlik el valami, mint ha természetesen következik be ugyanez.
Pedig az angol kutatók által használt CRISPR-Cas9 „molekuláris ollót” használták már többször, csak nem emberi embriókon (legalábbis a kínai eseten kívül nincs több kutatásról tudomásunk). A módszert 2012 óta ismerjük, ekkor jelent meg először a Science tudományos folyóiratban mint genetikai áttörés.

Az eszköz kifejlesztésében nagy szerepe volt a Berkeley Nemzeti Laboratórium kutatójának, Jennifer Doudnának és a francia Emmanuelle Charpentier-nek, akik egy újonnan felfedezett ribonukleinsav-komplexumot használtak arra, hogy az örökítőanyag meghatározott részére irányítva elvágják és módosítsák azt.

Az eljárás neve a csoportos, szabályosan megszakított rövid palindrom ismétlések angol megfogalmazásának rövidítése (Clustered Regurarly Interspaced Short Palindromic Repeats). A palindrom kifejezés itt azt jelenti, hogy a DNS bázissorrendje előre- és hátrafelé olvasva (a két, komplementer láncra vonatkoztatva) ugyanaz. A módszer segítségével a londoni Imperial College kutatói
sikeresen terméketlenné tettek maláriaszúnyogot
(Anopheles spp.), így pedig a populáció megtizedelődött. 2015-ben harvardi kutatók sikeresen távolítottak el 62 potenciálisan ártalmas DNS-szekvenciát a sertés genomjából, így hozzájárultak ahhoz, hogy a jövőben már sertésszerveket is beültethetnek emberi szervek helyére.

A Francis Crick Intézet kutatói egy mester-szabályozógén, az OCT-4, más néven a POU5F1 kiiktatásával kezdik a munkát, amely az osztódás során a magzatban fejlődik tovább. A hólyagcsíra-állapot során a DNS egyes részei igencsak aktívak, és valószínű, hogy
ezek a gének alakítják a fejlődés korai szakaszát,
így vizsgálatuk különösen fontos lehet. Az FCI tudósai a vetélés és a meddőség okait is keresik majd – ez azért fontos, mert átlagosan száz megtermékenyített petesejtnek kevesebb mint a fele éri el a hólyagcsíra állapotát, negyede kerül beültetésre, és csak 13 éli túl a harmadik hónapot.

Egyelőre fogalmunk sincs, mitől történnek ezek a spontán vetélések – remélhetőleg a közeli kutatások megfejthetik, mi megy tönkre a terhességnek ebben a korai szakaszában.
A most kiadott engedély tehát
még korántsem azt jelenti, hogy lassan elindulunk a dizájnerbabák felé vezető úton
– sokkal inkább a meddő anyáknak jelenthet reményt arra, hogy végre kiderül, mi okozza terméketlenségüket, és a spontán vetélésről is többet tudhatunk meg általa. Az, hogy az ilyen kutatások esetleges sikeressége mennyire lendíti elő a dizájnerbabák létrejöttét, még a jövő zenéje, de az ehhez hasonló szigorú korlátozások és a ma ismert technológiai lehetőségek egyelőre egyáltalán nem teszik lehetővé, hogy megtervezhessük, hogyan nézzen ki születendő gyermekünk.












