Áttörés a rákgyógyításban: kezesbárányt csináltak a legyőzhetetlennek hitt farkasból

Az újfajta technika lényege, hogy a ráksejt egyik túléléshez nélkülözhetetlen funkcióját, a celluláris újrahasznosítást kapcsolják ki, ami miatt az nem képes az út folyamán kivédeni az őt érő károsító hatásokat.
„Amikor a metasztatikus tumorsejtek elhagyják kényelmes fészküket, rengeteg veszélynek teszik ki magukat. Ezekkel csakis úgy birkózhatnak meg, ha kiválasztják a károsodás során keletkező celluláris hulladékot és hibás sejtkomponenseket, majd újrahasznosítják őket.
Amennyiben kikapcsoljuk az ezt lehetővé tévő sejtszervecskék, a lizoszómák működését, a tumorsejtek védtelenné válnak"
– magyarázta Michael J. Morgan, a Proceedings of the National Academy of Sciences című tudományos folyóiratban megjelent publikáció egyik szerzője.
Az autofágia görög eredetű szó, önemésztést jelent. A ráksejtek esetében e folyamat esszenciális ahhoz, hogy a létüket veszélyeztető sejten belüli sérült vagy szükségtelen struktúrákat elkülönítsék, majd lebontsák.
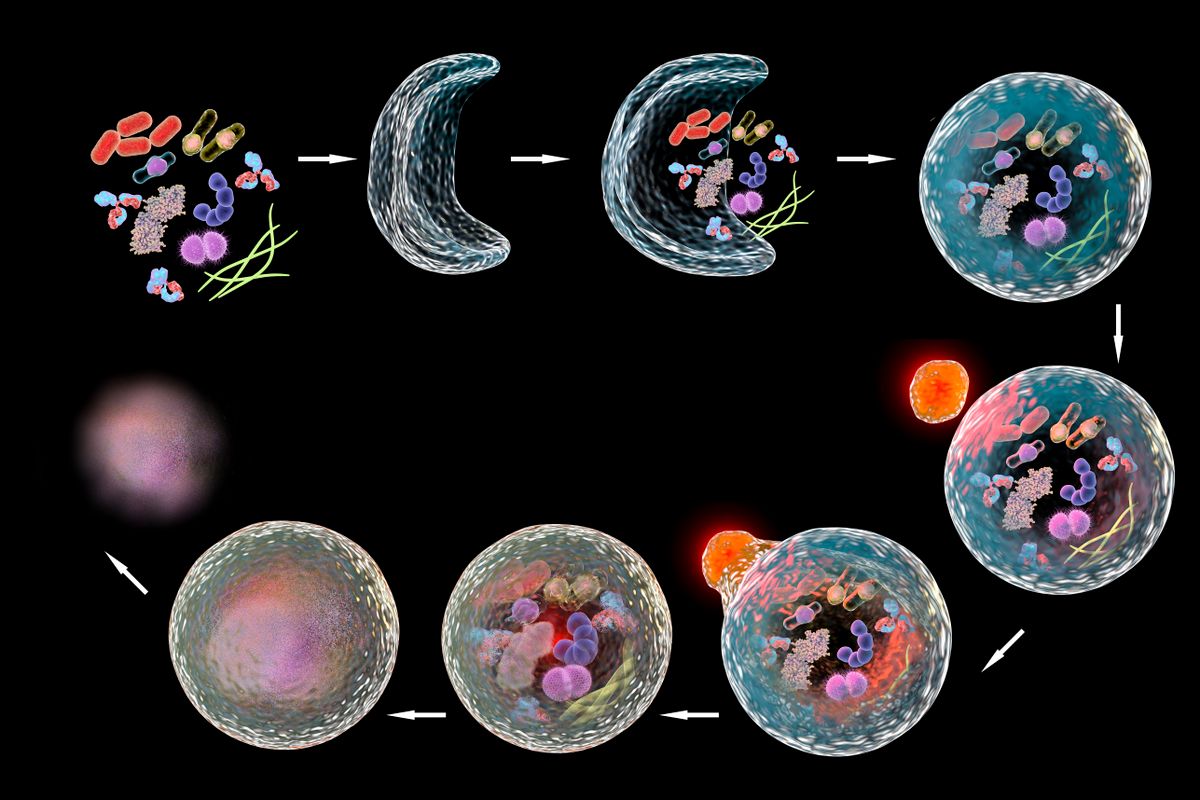
Első lépésként a kiiktatásra ítélt "hulladékot" a kettős membránnal határolt autofagoszóma nevű sejtszerkezet gyűjti össze és kebelezi be. Ezt követően lépnek akcióba a lizoszómák, amik a külső membránhoz érve egyesülnek az autofagoszómával, létrehozva az autolizoszómát. Az új struktúrába bekerülnek a lizoszóma enzimjei, amik végül lebontják a csapdába ejtett sejtkomponenseket. Így megnyílik az út, az újrahasznosíthatóság felé. A mechanizmust kiválóan szemlélteti az alábbi ábra.
„Különösen meglepett minket, hogy önmagában nem az autofágia folyamata volt az igazán fontos az áttétes sejtnek" – mondta Morgan. „Ha az önemésztést korai stádiumában sikerül blokkolni, akkor a metasztatikus és az áttétet nem képző tumorsejtek növekedése is lassul.
Jóval komolyabb csapást mérhetünk azonban az áttétes ráksejtre, ha az autofágia kései fázisában főszerepet kapó lizoszómák funkcionálását akadályozzuk, ez végzetesnek bizonyul számukra"
– folytatta a szakértő.
A kutatók erre úgy jöttek rá, hogy előbb genetikailag blokkolták az önemésztés folyamatát, majd egy másik kísérlet során a lizoszómák működését gátolták le klorokin tartalmú gyógyszerrel. Az autofágia genetikai blokkolása valamelyest lassította a jó- és rosszindulatú daganatok sejtjeinek fejlődését, a klorokin viszont a metasztatikus sejteknek csapott oda igazán;
míg a nem áttétes sejtek növekedését szimplán visszafogta, addig az áttétes daganatsejteket megölte.
„Volt valami lizoszómákkal kapcsolatos dolog, ami specifikusan ezekre az áttétes sejtekre jellemző" – mondta Andrew Thorburn, a metasztázisok vizsgálatának egyik nagy szaktekintélye, aki szintén részt vett a mostani tanulmány elkészítésében.
A válasz megtalálásához a tudósok klorokin-rezisztens sejteket állítottak elő. Először metasztatikus sejteket növesztettek kis mennyiségű klorokin jelenlétében. Nagy részük elpusztult, akadtak viszont túlélők, belőlük új sejtkultúrát hoztak létre, amit ismét a vegyület hatásának tettek ki.
A módszerrel pár generáció elteltével klorokin-rezisztencia alakult ki, ezzel párhuzamosan ugyanakkor a tumorsejtek elvesztették az áttétek létrehozásához szükséges képességüket is.
„Az ajtó mindkét irányba nyílik. Amikor klorokin-rezisztens sejteket választottunk ki, nem tudták megőrizni áttétképző tulajdonságukat, amikor pedig áttétképző sejteket szelektáltunk, akkor érzékennyé váltak a vegyületre. Nem növekedtek tovább és elpusztultak, mert hirtelen szükségük lett arra a lizoszomális funkcióra, amit a klorokin elvett tőlük" – magyarázta Morgan.
Dan Theodorescu, a Samuel Oschin Comprehensive Cancer Institute egyik munkatársa úgy véli, a klinikai gyakorlatban rövidesen hasznosítható lesz az új eredmény. „Ha van egy hólyagrákos betegünk, és klorokint adunk neki, feltételezhetjük, hogy néhány túlélő ráksejt rezisztenssé válhat a kemikáliára.
A tanulmányunk alapján azt is megjósolhatjuk, hogy bár ezek a sejtek újra növekedésnek indulhatnak, metasztázist már nem fognak képezni.
Ez mindenféleképpen a beteg előnyére válik" – mondta Theodorescu.
A publikációból egyebek mellett az is kiderül, hogy mely rákbetegeknél a legelőnyösebb a klorokinon alapuló terápia alkalmazása. Az ellenálló és a szenzitív sejtekben eltérő mennyiségben van jelen egy specifikus fehérje (ID4). Ha ennek a proteinnek a szintje alacsony, a sejtek képesek áttéteket létrehozni és egyúttal érzékenyek a klorokinre, ha az ID4 szintje magas, akkor kevésbé metasztatikusak és rezisztensek a készítményre.
A klorokint magukba foglaló jövőbeni klinikai próbák során az ID4-szint alapján dönthetik el az orvosok, hogy mely páciensekre lesz jótékony hatással a kezelés"
– vázolta Theodorescu. – „Ez arra hasonlít, mint amikor biomarkereket (jelzőanyagokat – a szerk.) keresünk a prognózis megbecsléséhez."
Az ID4 tehát segíthet abban, hogy az orvosok megjósolják egy hólyag-, mell-, és prosztatarákban szenvedő beteg túlélési esélyeit – ha az ID4 szintje magas, jó esélye van a gyógyulásra.
„Úgy tekinthetünk rá (a fehérjére), mint egy vélt biomarkerre" – summázta Thorburn.
Forrás: EurekAlert












