Először lesz két anyja gyerekeknek

Douglass Turnbull brit neurológus munkájának nagy részében olyan családokkal foglalkozik, ahol nemzedékről nemzedékre gyógyíthatatlan, többnyire végzetes betegségek öröklődnek. Mégis kevésszer érezte magát annyira tehetetlennek, mint amikor Sharon Bernardi látogatott el hozzá Edward nevű fiával.
Bernardi addigra már három gyermekét veszítette el: a csecsemők vérében órákkal a születés után savfelhalmozódás indult meg, melynek oka akkor még rejtély maradt. Ezért hatalmas megkönnyebbülés volt számára, amikor látta, hogy Edward elsőként végre normális fejlődésnek indul. A baba minden állomást rendben végigjárt: időben felült, kúszott, és 14 hónaposan járni is elkezdett. Nagyjából két évesen azonban elkezdett pár lépés után elesni, s nem sokkal később görcsrohamai alakultak ki. Végül 1994-ben, négyéves korában állapították meg az orvosok, hogy a központi idegrendszert sújtó ritka betegségben, a Leigh-szindrómában szenved, és azt jósolták édesanyjának, hogy gyermeke aligha éri meg az ötödik születésnapját.
A Newcastle-i Egyetemen (Anglia) dolgozó Turnbull szomorúan emlékeztet rá: bárhogyan igyekszünk is, ezeken a betegeken soha nem fogunk tudni érdemben segíteni. A Bernardi családdal való találkozása nyomán támadt frusztrációja arra sarkallta, hogy a mesterséges megtermékenyítés eszköztárában keressen megoldást azoknak a szerencsétlenül járt családoknak, ahol a gyerekek – Edwardhoz hasonlóan – egy úgynevezett mitokondriális gén pusztító hatású mutációját öröklik édesanyjuktól.
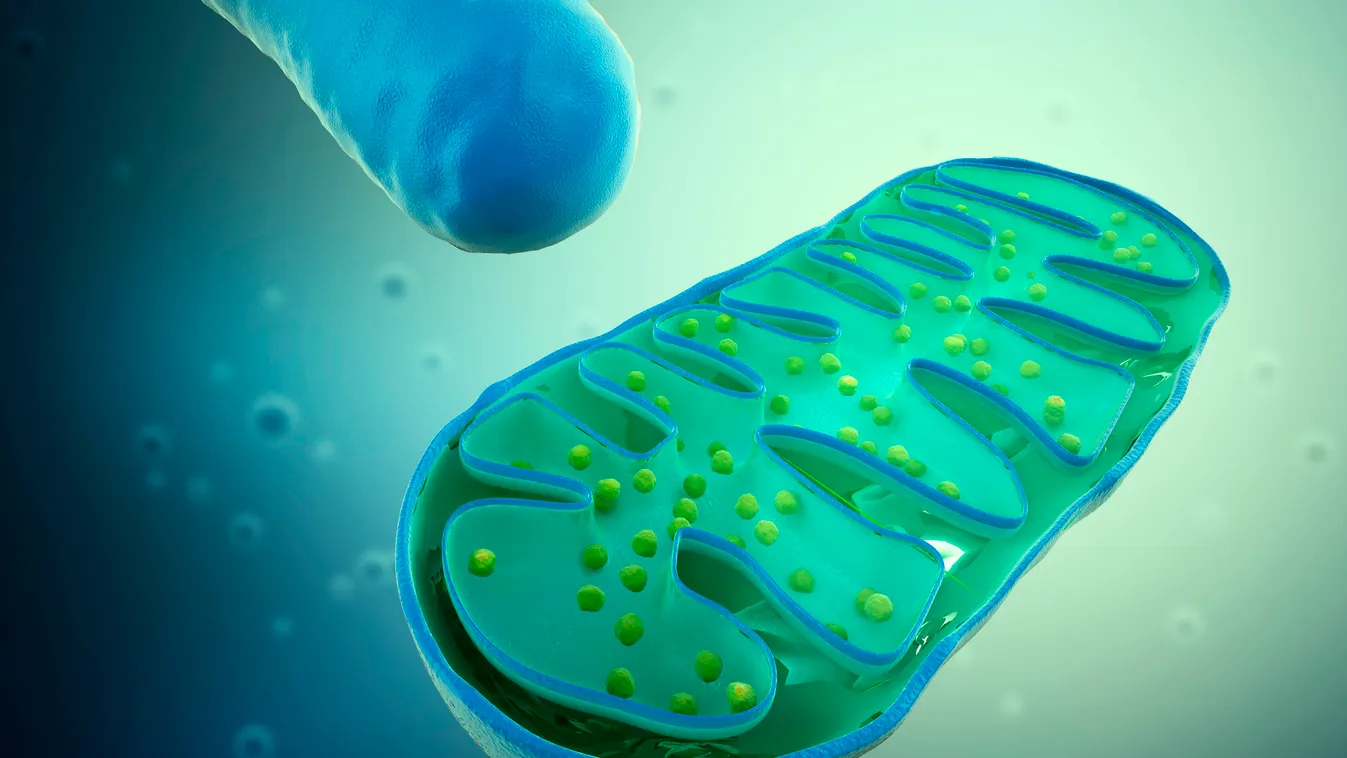
Amint arra a középiskolai biológiarákról sokan emlékezhetnek, a mitokondrium a sejt energiatermelő sejtszervecskéje. A mitokondriumoknak saját génjei vannak. Ha ezek károsan módosulnak (mutációk), az súlyos anyagcsere-betegségekhez vezethet.
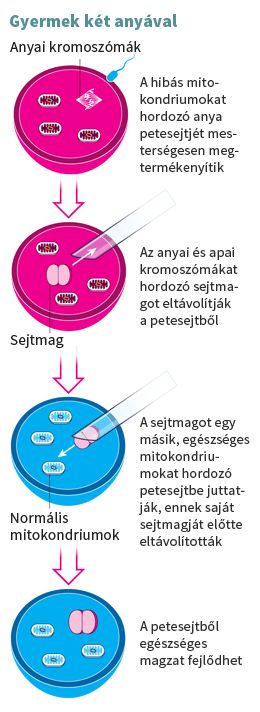
Turnbull megtalálta az eljárást, amely megoldást jelenthet ezeknek a családoknak a tragédiájára: ez a háromszemélyes mesterséges megtermékenyítés néven emlegetett technika (lásd a bal oldali ábrán).
Az eljárás során a mutáns mitokondriumokkal rendelkező anya – a gyerek igazi anyja - megtermékenyített petesejtjéből kiemelik a sejtmagi genetikai anyagot.
A kiemelt genetikai anyagot ezután egy másik nő – ő a gyerek „második anyja” – olyan petesejtjébe ültetik át, amelynek saját sejtmagját előzően eltávolították. Ez a kiüresített petesejt egészséges mitokondriumokat tartalmaz. Ez biztosítja, hogy a az igazi anyag hibás mitokondriumai nem adódnak tovább a fejlődő magzatba.
Turnbull és mások egereken, majmokon és tenyészetben fenntartott emberi petesejteken is tesztelték már az eljárást, s most állítják: elérkezett az ideje az emberi kipróbálásnak. A kérdés még az év folyamán a brit parlament elé kerül, és ha a törvényhozás jóváhagyja, az Egyesült Királyság lehet a világ első országa, ahol meg nem született gyermekek effajta genetikai módosítását engedélyezik.
A ma elfogadott elmélet szerint egy valaha szabadon élő baktériumtól származik, amelyet több mint másfél milliárd éve kebeleztek be a mi sejtjeink őse. Utóbbinak főleg az a haszna származott e házasságból, hogy a mitokondrium oxigén felhasználásával nagy mennyiségű energiahordozó adenozin-trifoszfát (ATP) molekulát volt képes termelni, s ezek egy részét a kezdetektől fogva átadta az őt befogadó gazdasejtnek. Ma is az ATP-termelés, vagyis az energiaszükséglet fedezése a mitokondriumok fő feladata sejtjeinkben. S bár az együttélés évszázmilliói alatt a befogadott baktérium génállományának jelentős hányadát elvesztette, így önálló életre képtelenné vált, egy csökevényes készletet mindmáig őriz őseinek genomjából. Az emberi mitokondriumok genomja például 37 génből áll (ami nemcsak a sejtmagi genomunk sok tízezer sejtmagi génjéhez, de egy szabadon élő baktérium génkészletéhez viszonyítva is maroknyi).
Ellentétben sejtmagi génállományunkkal, amelyhez mindkét szülőnk egyenlő arányban hozzájárul kromoszómáival, mitokondriumainkat kizárólagos módon anyai ágon örököljük, aki néhány ezret csomagol belőlük minden petesejtbe. Még nem teljesen tisztázott okból a mitokondriális genom jóval kevésbé stabil, mint a sejtmagi: körülbelül ezerszer magasabb arányban szenved véletlen mutációkat. Ezért nem meglepő, hogy kb. minden ötezredik gyermek mitokondriális mutációtól sújtva jön világra, s mivel a mitokondrium fő szerepe az energiatermelés, e mutációk a leginkább energiaéhes szerveinket – az agyat, a szívizmot – érintik a legrosszabbul. A kialakuló betegség súlyossága attól függ, hogy a petesejttel átadott mitokondriumok mekkora hányada hordozta a káros mutációt.
Miután Turnbullt az 1990-es évek közepén felkereste a Bernardi család, egy Sharontól vett izombiopszia igazolta, hogy az anya csakugyan mutáns mitokondriumokkal rendelkezik. „Az orvos nem értette, hogy lehetek egyáltalán ilyen jó állapotban” – meséli Sharon, akinek ez a felismerés segített utólag megérteni néhány olyan egészségügyi problémát, amely nála vagy a család többi tagjánál jelentkezett. Mint kiderült, az ő édesanyjának is több gyermek elvesztését kellett megszenvednie, és ötvenes éveitől kezdve szívproblémákkal küszködött. Ezen kívül Sharon unokatestvére és más, távolabbi családtagjai is elveszítették gyermekeiket. A Bernardi család tragédiája indította Turnbullt annak kidolgozására, miként lehetne a betegségokozó mitokondriumok továbbadását megakadályozni.
A gondolat mások számára sem volt teljesen ismeretlen. Embriológusok egerekkel az 1980-as évek óta dolgoztak a „pronukleáris transzfer”-nek nevezett technikákon, melyek révén a petesejt citoplazmájának az embrió fejlődésére gyakorolt befolyását tanulmányozták. Ezen eljárások során egyik megtermékenyített petesejtből a másikba ültetik át a sejtmagi DNS-t úgy, hogy a befogadó petesejt többi sejtalkotóját – köztük a mitokondriumokat – nagyrészt megőrzik. Az e területen dolgozó kutatók 1995-ben felvetették, hogy efféle beavatkozással emberi petesejtekben is elejét lehetne venni a mitokondriumok okozta betegségek továbbadásának.
Turnbull laboratóriuma a korai 2000-es évektől kezdve igyekezett megismételni a mások által elért eredményeket, hogy minél gyorsabban továbbléphessenek az emberi petesejtekkel való kísérletezésre. Két reproduktív biológus kollégával, a Newcastle-i Egyetemen és a hozzá tartozó meddőségi klinikán egyaránt dolgozó Mary Herberttel és Alison Murdoch-kal együtt az volt a tervük, hogy lombikbébi-programból visszamaradt, sikertelenül megtermékenyített petesejteket fognak felhasználni, amelyek különben sem fejlődhettek volna embrióvá.
Másfél évükbe tellett, mire a hatóságokat rábírták az első kísérletek engedélyezésére. A brit Humán Megtermékenyítési és Embriológiai Hatóság kétszer visszautasította a csoport kérelmét arra hivatkozva, hogy a tervezett eljárással megváltoztatnák a petesejtek „genetikai szerkezetét”, ami a hivatal létrejöttét kimondó, azzal azonos nevű 1990-es törvény szerint illegálisnak minősül. Válaszukban a kutatók a „genetikai szerkezet” fogalmának tisztázatlanságát kifogásolták, és amellett érveltek, hogy a pronukleáris transzferre a mondottak nem vonatkoznak. Harmadjára is benyújtották kérelmüket, s a jogászok ezúttal a javukra döntöttek, így 2005-ben végre kezükben tudhatták a várva várt engedélyt.

Bár a preklinikai kísérletek immár 2005 óta zajlanak, számos kérdés mindmáig tisztázásra vár. Vajon elég hatékony-e a transzfer ahhoz, hogy az előállított embrióval egy nőnek esélye legyen teherbe esni? Nem okoznak-e a művelet során olyan molekuláris vagy genetikai eltéréseket, amelyek hátráltathatják az embrió későbbi fejlődését, vagy egészségi problémákat okozhatnak a születés után? S vajon valaha is engedni fogja-e a brit kormány, hogy a kísérletek átlépjenek a klinikai gyakorlat küszöbén?
A newcastle-i csoport az elmúlt éveket a válaszok keresésével, és a technika emberi petesejtekhez történő finomhangolásával töltötte. „Elég biztosak vagyunk benne, hogy van esély a teherbe esésre” – állítja Herbert. A mindeddig publikálatlan kísérletek eddig lassan haladtak, részben az egészséges emberi petesejtek korlátozott hozzáférhetősége miatt; ennek ellenére Herbert becslése szerint már túl vannak a századik pronukleáris transzferen. A kutatónő abban is bízik, hogy hamarosan módjuk lesz biztonságossági tanulmányokat is végezni annak felmérésére, nem változtatja-e meg a transzfer az átültetett sejtmagok genetikai vagy epigenetikai jellemzőit. De nincs az a vizsgálat, ami teljes bizonyosságot nyújthatna, mielőtt az emberi kipróbálás megkezdődik. „Sose fogjuk tudni azt állítani, hogy száz százalékig biztonságos, amit csinálunk” – véli Herbert. – „Egyszer csak el kell kezdenünk a valódi kezeléseket.”
Hogyan végzik a sejtmag-átültetést?
Az emberi petesejt átmérője a milliméter tizedrésze, így a pronukleáris transzfert mikroszkóp alatt végzik egy speciálisan kialakított, szabályozott hőmérsékletű és légáramlású kamrában. A művelet tapasztalt és biztos kezű embriológust kíván: a szakemberek sokadjára is ugyanúgy visszatartják közben a lélegzetüket. A transzfert végző embriológus először az egyik megtermékenyített petesejt sejthártyáját lézerrel bemetszi, majd leheletvékonyra húzott üvegpipettával behatol a lyukon, és kiszippantja a zigóta sejtmagpárját. Ezután a másik, befogadásra szánt megtermékenyített petesejt kerül sorra: ebből is kiszippantja a két pronukleuszt, majd az előbb kivett sejtmagokat az így kiürített zigótába fecskendezi. Az egész mutatvány – a megfelelő gyakorlattal végrehajtva – mindössze pár percet vesz igénybe. Ha a brit törvényhozás rábólint a technika klinikai alkalmazására, az így előállított zigótákat pár napig még a laborban növeszthetik, míg el nem érik az 50-200 sejtes hólyagcsíra-állapotot, majd ebben a formában beültethetik az erre váró anya méhébe.












