Az Európai Bizottság jóváhagyta a Remsima gyógyszerek forgalomba hozatali engedélyét, így az Egis megkezdheti a termék értékesítését. A Remsima az első készítmény abban az együttműködési megállapodásban, amit az Egis a koreai partnerével, a Celltrionnal kötött 2010-ben. Az Egis kizárólagos forgalmi jogot szerzett 5 FÁK országban, beleértve Oroszországot, továbbá 12 közép-európai országban társ-kizárólagosságú jogot kapott a készítmények forgalmazására.
Az Európai Bizottság forgalomba hozatali engedélye és a Celltrionnal kötött megállapodás révén az Egis vezetheti be a Remsimat Közép-Kelet-Európában, ezen belül Bulgáriában, Csehországban, Lengyelországban, Lettországban, Litvániában, Magyarországon, Romániában és Szlovákiában.
A jóváhagyás mérföldkőaz európai egészségügy számára, a Remsima ugyanis az első biohasonló monoklonális antitest (mAb), amelyet az Európai Bizottság engedélyezett az Európai Gyógyszerügynökség szakvéleménye alapján.
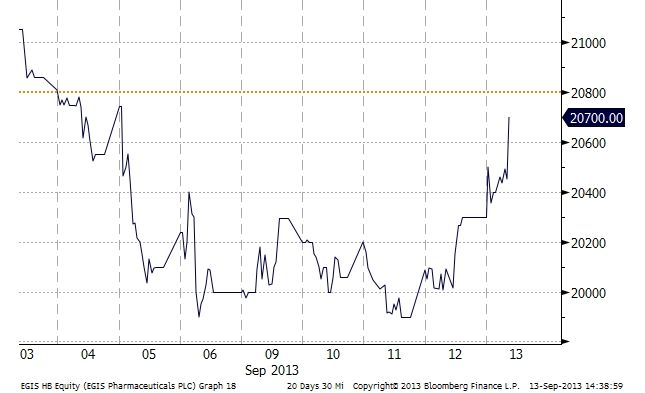
A kedvező hírekre tovább emelkedett az Egis részvényeinek árfolyama, mely egy hetes csúcsára ért fel.
Egis árfolyama


Házasság első látásra: összeomlott a menyasszony

Ezért került nehéz helyzetbe Lisztes Krisztián a német sztárcsapatnál

Megdöbbentő nyilatkozatott tett Andrei Mangra ismerőse: „Nem ugyanaz, nem önmaga"

Ilyen, amikor Magyar Péter trágár szavakkal gyalázza egy gyermekotthon vezetőjét + videó

Szalah kezdhet csomagolni, megvan a gólerős utódja

Lecsapott a NAV a magyar bűnszervezetre: hihetetlen vagyont talált – fotók

Az angol sztárfocista felvállalta kapcsolatát a párductestű szőke szépséggel - galéria

Döntő lépésre szánta el magát Putyin

A kamerák előtt vertek meg egy benzinkutast, itt a felvétel

Mutatjuk, hol kell előkészíteni a hólapátot, több centi hó is eshet

Alpesi cunami söpörte el az osztrák községet
