A Richter közleménye szerint az Európai Gyógyszerügynökség Emberi Felhasználásra Szánt Gyógyszerkészítmények Bizottsága (CHMP) pozitív véleményt adott ki a társaság módosítási kérelmére az Esmya alkalmazásának meghosszabbításáról.
Az ún. „II-es típusú módosítás” kérelmet 2013 júliusában nyújtotta be a Richter. A CHMP pozitív véleménye továbbításra kerül az Európai Bizottság felé, amely előreláthatólag a vélemény kiadásától számított két hónap múlva az Európai Unió valamennyi tagállamára kiterjedő hatállyal módosítja az Esmya 5 mg-os készítmény forgalomba hozatali engedélyét.
Az Esmya 5 mg-os tabletta 2012. február 23-án kapott, az Európai Unió valamennyi tagállamára kiterjedő forgalomba hozatali engedélyt fogamzóképes korú felnőtt nőknél kialakult méhmióma enyhébb és súlyosabb tüneteinek műtét előtti kezelésére. A kezelés időtartama jelenleg három hónapra korlátozódik. A most kiadott CHMP véleményre alapozva lehetőség nyílik egy újabb, három hónapos kezelési időszakra kiterjeszteni az Esmya 5 mg-os tablettára kiadott forgalomba hozatali engedélyt.
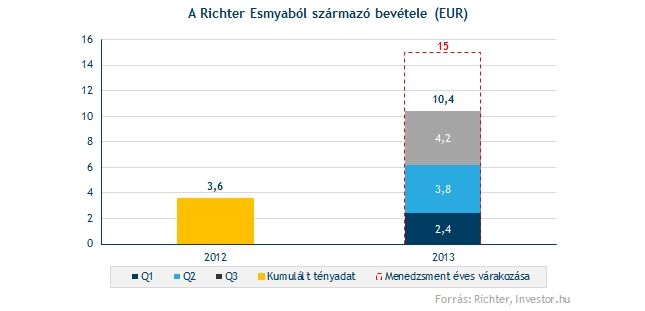
2013 első kilenc havában a Richter eddig 10,4 millió eurós árbevételt ért el az Esmyán keresztül, ami jókora megugrásnak számít a tavalyi egész évben generált 3,6 millió eurós értékestési adatot követően. Az idei bevételi terv egyébként 15 millió euróra tehető, ami a növekedési dinamika alapján teljesíthető célnak tűnik.
Az már jól látszik, hogy az idei év bevételi adatait nem fogja befolyásolni a CHMP friss véleménye, melyet egyébként nagyjából az év végére, rosszabb esetben a jövő év elejére vártak a gyógyszercégnél. 2014-et tekintve a Richternél kérdésünkre elmondták, hogy egyelőre mérsékelt hatást várnak a jelenlegi bejelentéstől. A tényleges bevételi terveket pedig februárban az éves jelentés közzétételét követően hozzhatja nyilvánosságra a társaság.


Itt van Zaluzsnij bejelentése: Elkezdődött a harmadik világháború

Miss Universe: nem kímélik a győztes nőt

Forgács Gábor temetése: a havazás szívszorító helyzetet hozott - Fotó

Nagy Bandó Andrásnak elgurult a gyógyszere, elvakította az Orbán-gyűlölet

Mélyütés a magyar válogatottnak, betett Szoboszlaiéknak az UEFA

Beszakadt a forint, ez állhat a szabadesés hátterében

Újabb hangfelvétel érkezett Magyar Péterről, amelyen arról beszél, hogy bármilyen nőt megkaphat

Farkasóra: ezért ébredünk fel hajnali három és négy óra között

Andrei Mangra botránya folytatódik: egy boltban is balhézott a táncos

Az autójában és az osztályteremben is megerőszakolta a diákját egy tanárnő

Észbontóan szexi barátnője adhat erőt Max Verstappennek az újabb vb-győzelemhez
