Ifjonti tanulékonyságunk ára az időskori elbutulás

Ugyanaz a folyamat, amely lehetővé teszi, hogy agyunk emléknyomokat rögzítsen, a kor előrehaladtával elménk hanyatlását idézi elő – rukkoltak elő a meglepő felvetéssel az MIT (Boston, USA) kutatói.
A Cell c. folyóiratban nyilvánosságra hozott felfedezésről az MIT külön sajtóközleményben is beszámolt.
A tudósok szerint az új agyi mechanizmus megismerése kulcsot adhat a kezünkbe a szellemi képességek leromlásával járó betegségek, például az Alzheimer-kór jobb megértéséhez és megelőzéséhez.

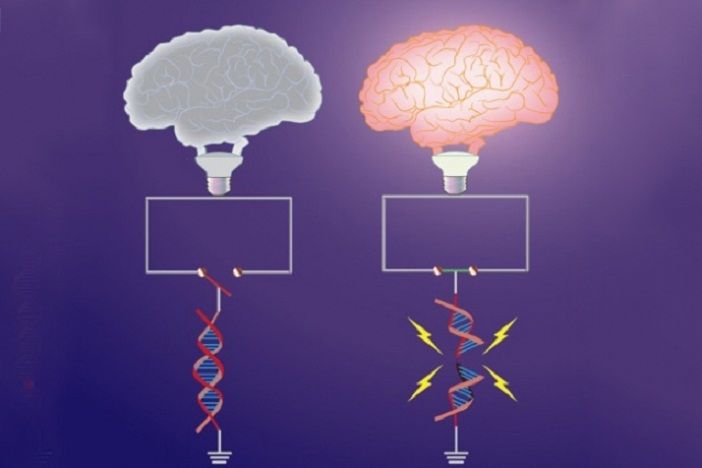
Valahányszor újdonságot tanulunk, agysejtjeink eltördelik DNS-üket; ezzel olyan kár keletkezik, amit a sejteknek azonnal ki kell javítaniuk”
– fogalmaz Li-Huei Tsai. Az MIT tanulással és emlékezéssel foglalkozó kutatóintézetében, a Picower Institute for Learning and Memory-ban dolgozó idegtudós szerint ez a folyamat nélkülözhetetlen az emlékek rögzítéséhez.
„A DNS eltördelése élettani folyamat, amely mindenféle sejtben zajlik, és célja egyes kulcsfontosságú gének kifejeződésének elősegítése” – magyarázza a professzor. –
„Konkrétan az idegsejtekben a DNS eltördelése az úgynevezett korai válaszadó gének aktivitásához szükséges, amelyek elindítják a tanuláshoz és az emléknyomok rögzítéséhez szükséges génkifejeződési programot.
”Ahogy azonban öregszünk, agysejtjeink képessége a DNS hibáinak kijavítására egyre gyengül, ezért a tanulás érdekében létrehozott törések összeforratlanul maradnak, s
ez végső soron az agy leépüléséhez vezet.
„Amíg fiatalok vagyunk, nem gond, hogy az agyunk tanulás közben DNS-töréseket hoz létre, mert a sejtek teljes mértékben uralni tudják a helyzetet, azonnal kijavítják a keletkező hibákat, és fenntartják a rendszer működőképességét. Az idősödő agy viszont – különösen egyes örökletes betegségekben – csökkent hatékonyságú DNS-hibajavító apparátussal rendelkezik, így a kettősszálú törések (vagyis a DNS mindkét szálát érintő folytonossági hiányok) felhalmozódnak. Véleményünk szerint ez rendkívül káros lehet az agyra nézve” – nyilatkozta Tsai.
Korábbi munkájuk során az MIT kutatói az Alzheimer-kór egerekben létrehozott modelljét vizsgálták. Kísérleteik azt derítették ki, hogy az emléknyomok rögzítéséért felelős agyi régióban, a hippokampuszban az idegsejtek már a betegség korai, tünetmentes fázisában is nagyszámú kettősszálú DNS-törést halmoznak fel.

Mivel szerették volna megérteni, miért és miként keletkeznek a törések, és milyen géneket érintenek, egy másik kísérletben olyan mérgező anyag hatásának tették ki az idegsejteket, amely ismerten kettősszálú töréseket idéz elő. Ezt követően RNS-szekvenálást hajtottak végre, melynek segítségével meghatározták, hogy a toxikus kezelés hatására mely gének kifejeződése változik meg az idegsejtekben.
Azon, hogy a 700 megváltozott kifejeződésű gén túlnyomó többsége csökkent aktivitást mutatott, nem lepődtek meg különösebben a kutatók, hiszen ez az, amire a DNS károsodása esetén eleve számítani lehet.
Annál inkább váratlanul érte őket, hogy 12 olyan gén, amelyről tudott volt, hogy az idegi stimulusokra – például új érzékszervi benyomásokra – azonnali fokozott termeléssel válaszolnak, a kettősszálú törések hatására is rögtön működésbe lendültek.

Ezek után már csak azt kellett tisztázni, hogy a stimulálás és a kettősszálú törések az idegsejtek normális működése során is összekapcsolódnak-e egymással. Ehhez a tudósok olyan anyaggal kezelték a neuronokat, amely a szinapszisok – az idegsejtek közötti kapcsolatok – megerősödését váltja ki, ugyanúgy, mint a természetes tanulási folyamat. Az eredmény: a kezelés egyidejűleg növelte a korai válaszadó gének aktivitását és a kettősszálú törések számát, vagyis
a kapcsolat igazolódott.
A Tsai munkacsoportjában dolgozó Ram Madabhushi ezt követően megállapította, hogy a stimulusfüggő kettősszálú törések létrehozásáért a topoizomeráz IIβ nevű enzim felelős. Ha meggátolták az enzim a működését, mind a kettősszálú törések száma, mind a korai válaszadó gének kifejeződése leesett.
Egyértelművé vált tehát, hogy a kettősszálú törések nemcsak velejárói a tanulási folyamatnak, hanem elengedhetetlenül szükségesek hozzá. Azt azonban továbbra sem értették a kutatók, vajon a korai válaszadó gének aktiválása miért igényel ilyen drasztikus DNS-szerkezetváltozást.

Számítógépes elemzésnek vetették alá az e gének környezetében található DNS-szekvenciákat, és azt találták, hogy a korai válaszadó gének szabályozó régióiban különösen gyakran fordul elő az a motívum, amely a CTCF nevű fehérjét megköti. A CTCF-ről pedig ismert, hogy szerkezeti DNS-kötő fehérjeként hurkokat, hajtűkanyarokat hoz létre a nukleinsavszálon.
A korai válaszadó gének esetében a CTCF keltette hurkok olyan DNS-DNS kölcsönhatásokat akadályoznak meg, amelyek szükségesek volnának a gének kifejeződéséhez; jelenlétükben tehát a korai válasz génjei némák maradnak. A kettősszálú DNS-törések ellenben lehetővé teszik a hurkok kitekeredését, így megszüntetik a gének átíródása útjában álló akadályt. „Meglepő módon tehát a DNS-törések, amelyeket a közvélekedés kártékonyként könyvel el, hiszen mutációkat okozhatnak, sőt, végső soron akár daganathoz is vezethetnek,
valójában fontos élettani funkciót látnak el a sejtekben
” – summázta Tsai.
Olyan korábbi adatok alapján, amelyek szerint a tanulásban és emléknyomok rögzítésében szerepet játszó gének kifejeződése az életkorral egyre csökken, Tsai és munkatársai most azt tervezik vizsgálni, miként befolyásolja az öregedés a DNS hibáit javító rendszer működését.
Sejtésük szerint, amennyiben a sejtek hibajavító rendszere a korral hanyatlik, az öregedő idegsejtek egyre kevésbé lesznek képesek megbirkózni a tanulás során folytonosan keletkező kettősszálú törésekkel. Ha pedig így áll a dolog, olyan vegyületeket is keresnek majd, amelyek növelik az agy DNS-hibajavító kapacitását, s ezzel segítenek megelőzni az időskori elbutulást.












