Halálos daganatokat gyógyított meg egy új rákterápia
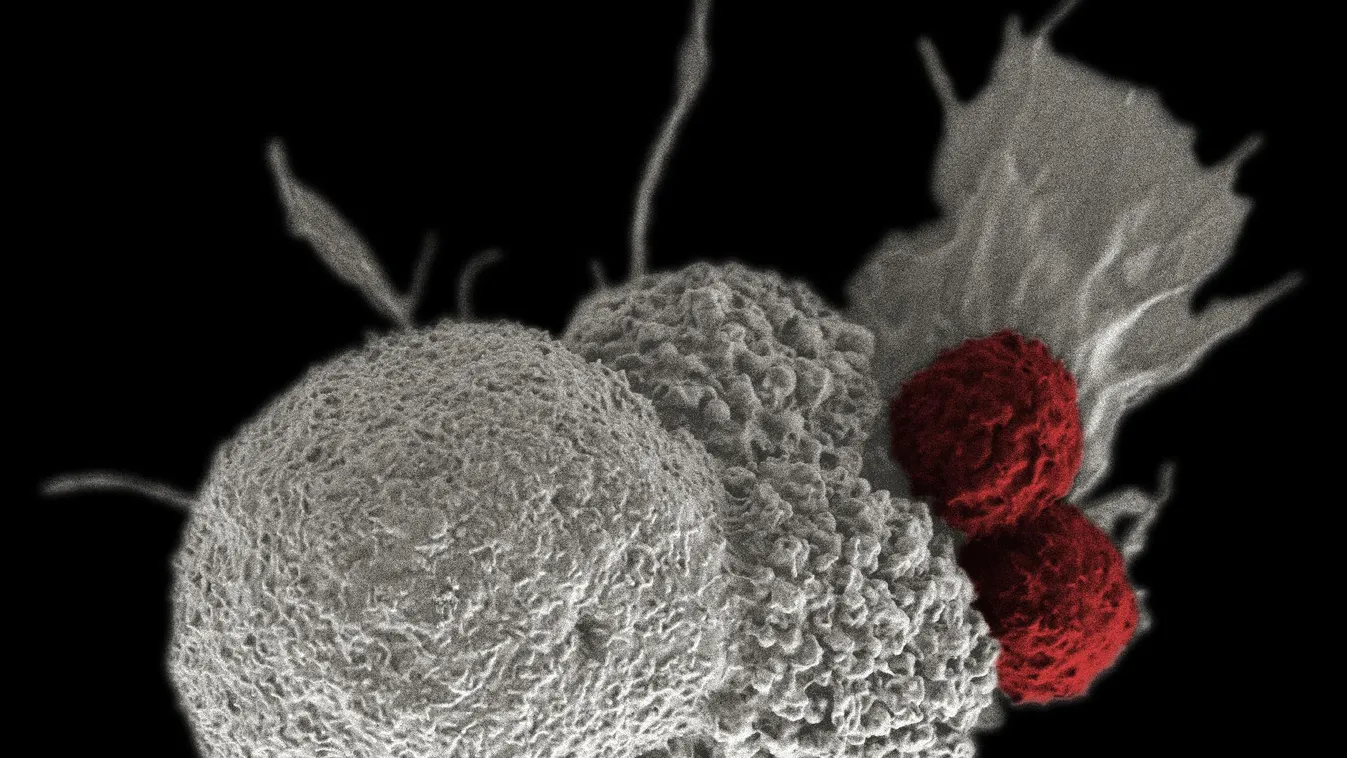

A kísérleti szer hatását felmérő 2-es fázisú klinikai vizsgálatba 32, különböző fajta daganatokban szenvedő beteget vontak be. A daganatok közös jellemzője az volt, hogy növekedésük az AKT jelátviteli fehérje egy ritka mutációjához, az E17K aminosavcseréhez volt köthető, ezért a kutatók abban bíztak, hogy a több sikertelen kezelésen átesett betegeken a szájon át adható új AKT-gátló molekula, az ipatasertib esetleg hatékony lehet. Az NCI-MATCH néven futó vizsgálat eredményeit az EORTC, NCI és AACR rákkutató szervezetek által közösen rendezett barcelonai Molekuláris Célpontok és Rákterápeutikumok Szimpóziumán (Symposium on Molecular Targets and Cancer Therapeutics) mutatták be. Az előadásból az derült ki, hogy az ipatasertib klinikailag jelentős aktivitással bír ezekben a többszörösen előkezelt betegekben.
Az AKT1 gén E17K mutációját hordozó daganatokban az ipatasertibre adott objektív klinikai válasz 22%-os volt, vagyis a 32-ből 7 betegben a daganat zsugorodott. További 18 betegben (56%) pedig stabilizálni sikerült a betegséget, vagyis a tumor nem zsugorodott ugyan, de nem is nőtt"
– összegezte Carolyn McCourt, a Washington Egyetem (St. Louis, Missouri, USA) nőgyógyászati onkológusa.
Az Egyesült Államokban zajló klinikai vizsgálatot az ECOG-ACRIN Rákkutatási Csoport vezeti a Nemzeti Rákkutató Intézettel (National Cancer Institute, NCI) és a Nemzeti Egészségügyi Intézethálózattal (National Institutes of Health) együttműködésben, az NCI Nemzeti Klinikai Vizsgálati Hálózata közreműködésével. Az NCI-MATCH klinikai vizsgálat 39 párhuzamosan futó klinikai karon (betegcsoporton és kezelési ágon) zajlik, és célja annak meghatározása, hogy a betegek milyen arányban adnak objektív – részleges vagy teljes – választ a kísérleti kezelésekre. Az előre lefektetett szabályok szerint a 16%-nál magasabb összesített válaszráta egy kísérleti karon azt jelzi, hogy az adott kezelés további, szélesebb körű klinikai kipróbálásra érdemes.
A 22 százalékos válaszarány klinikailag igazolja, hogy az AKT1 E17K mutációjával bíró betegek jól reagálhatnak az AKT-gátlószerekre, és a kapott biztató adatok indokolják a további kísérleteket"
– emelte ki McCourt, hozzátéve: pillanatnyilag nincs még forgalomban hatóságilag engedélyezett AKT-gátló daganatellenes szer, de az ilyen hatóanyagokat akár egyedül, akár kombinációban kipróbáló klinikai vizsgálatok több részleges sikert is felmutattak.
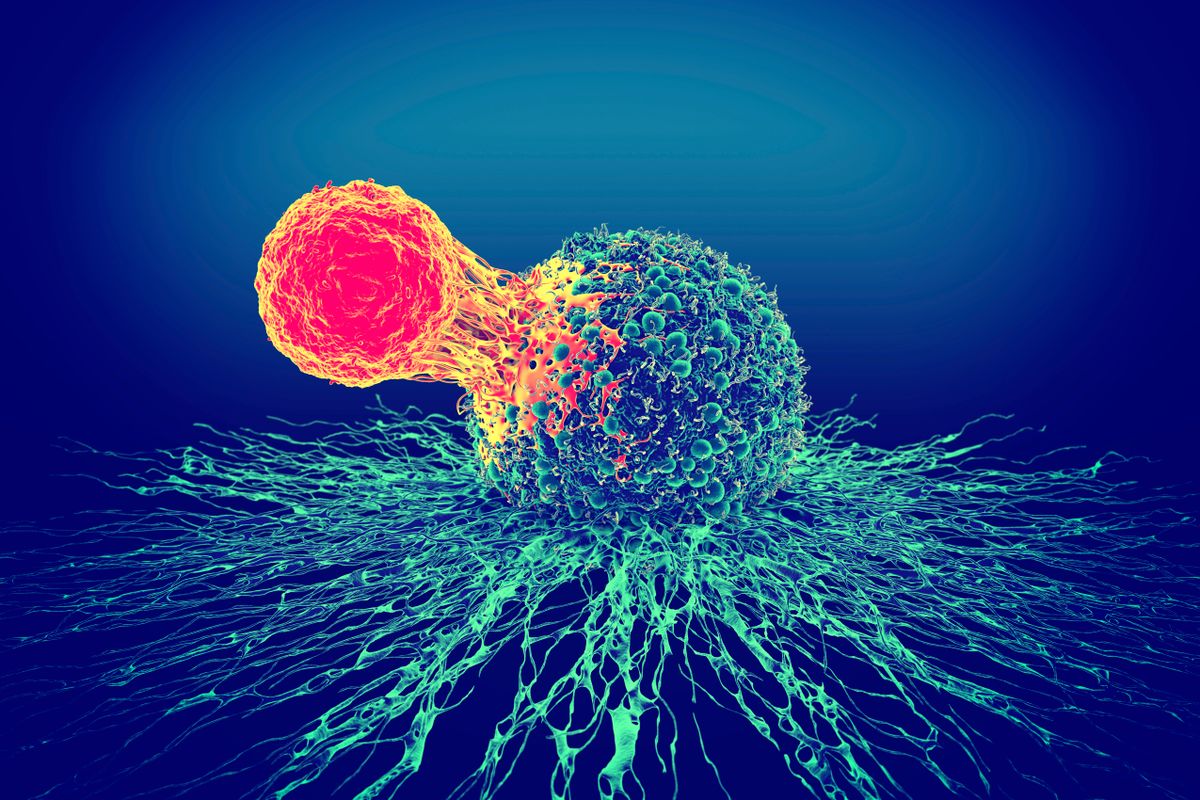
A most ismertetett klinikai kísérlet a második azon NCI-MATCH-vizsgálatok sorában, amelyek igazolják az AKT-gátlószerek klinikai aktivitását az AKT1 E17K mutációval rendelkező daganatos betegek körében. Az ezt megelőző vizsgálatban egy másik szájon át szedhető AKT-gátló, a capivasertib bizonyult hatékonynak az áttétes E17K-mutáns daganattal kezelt betegekben. A capivasertib a 35 kezelt betegből 10-ben eredményezett objektív választ, ami 28.6%-os válaszaránynak felel meg. Mindkét kísérlet az ún. gyűjtőkosár típusú vizsgálatok közé tartozott, amelyekbe többféle daganattípusban szenvedő betegeket toboroznak valamiféle közös molekuláris jellegzetesség – ez esetben az AKT E17K mutáció – alapján.
„Izgalmas egy újabb olyan NCI-MATCH-vizsgálatot látni, amely bizonyítja az AKT E17K mutációt célzó terápiák daganatellenes aktivitását és számottevő klinikai hasznát" – nyilatkozta Kevin M. Kalinsky, az atlantai (Georgia, USA) Emory Egyetem Winship Rákterápiás Központjának onkológusa, aki mindkét vizsgálatot irányította.
Bár az AKT-fehérjét is magában foglaló ún. PI3K-AKT jelátviteli útvonal zavarai nagyon elterjedtek a daganatokban, kimondottan az AKT-gének mutációi meglehetősen ritkák; az emlőrákoknak például csak mintegy 2-3%-ában fordulnak elő. E ritka eseteken belül viszont a legjellemzőbb az AKT1-génnek az a pontmutációja, amely az egyik kulcsfontosságú fehérjerészletben, a pleckstrin homológiadoménben a 17-es sorszámú glutaminsavat (E) lizinre (K) cseréli (E17K). Daganatokban és ráksejttenyészetekben végzett kísérletek egyöntetűen bizonyították az aktivált AKT-fehérje mennyiségének növekedését az E17K pontmutáció hatására, és minél magasabb az AKT aktiváltsági szintje egy daganatban, annál érzékenyebb lesz az AKT gátlására.
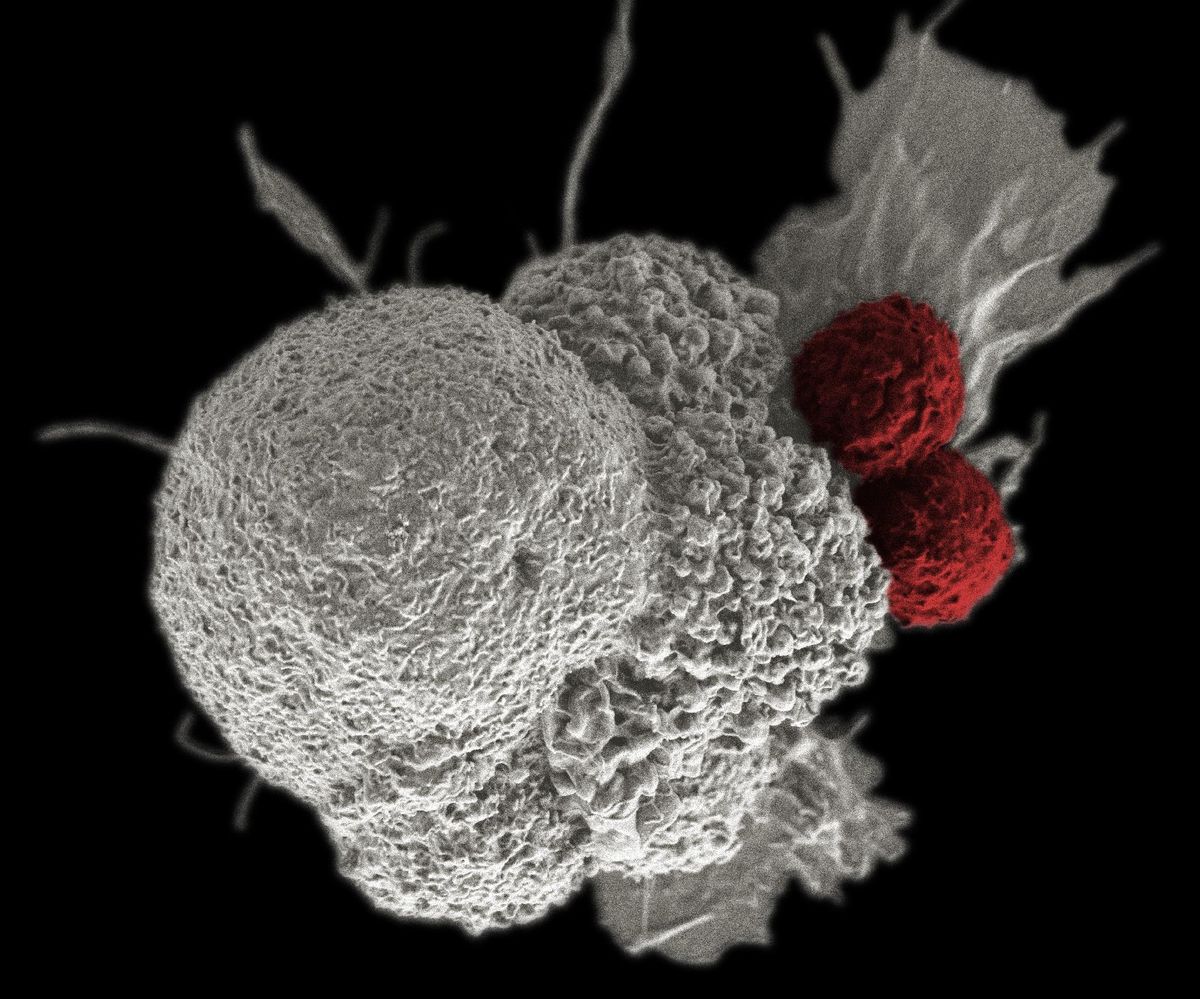
A most bemutatott klinikai vizsgálatban 32 beteg eredményeit értékelték. Közülük 20-an melldaganatban, 7-en nőgyógyászati daganatokban, 2-en prosztatarákban, a többiek különböző egyéb daganattípusokban (a végbélnyílás, a nyálmirigy, illetve a tüdő laphámrákjaiban) szenvedtek. A 32 betegből 27-en már három vagy több kezelésen átestek, s ennek ellenére kiújult a daganatuk, így a kísérleti terápia volt az utolsó esélyük.
A résztvevők 28 napos ciklusokban napi egyszer 400 mg szájon át bevehető ipatasertibet kaptak addig, amíg a daganatuk újból növekedésnek nem indult, vagy tolerálhatatlan mellékhatások nem jelentkeztek. Bár teljes gyógyulást egyik betegnél sem sikerült elérni – ami ebben a többszörösen előkezelt betegcsoportban nem is volt várható –, összesen hét (négy mellrákos, egy méhtestrákos, egy végbélrákos és egy nyálmirigyrákos) betegben részleges választ tapasztaltak. A betegek medián túlélése a kezelés megkezdésétől számítva 18 hónap volt; 44 százalékuknál a betegség súlyosbodását fél évig sikerült megfékezni. Az eredmények ismertetésének pillanatában két páciens még kapta a kezelést; ők eddigre 19, illetve 26 hónapig éltek túl az új gyógyszer segítségével.
Az bizonyos, hogy valami ígéreteset találtunk, de további klinikai vizsgálatokban kell majd tisztáznunk, miért volt az, hogy egyes betegek egyáltalán nem válaszoltak a kezelésre, míg másoknál a terápia hosszú időre megakadályozta a tumor növekedését
– mondta el McCourt. – Terveink szerint további elemzéseket végzünk a tumorszöveteken, hogy kiderítsük, van-e még más olyan molekuláris tényező, amely segít megjósolni, melyik betegnél várható terápiás válasz az új szerre."











