Fontos áttörés a felnőttkori leukémia terápiás lehetőségeiben

Az MTA Természettudományi Kutatóközpont (TTK) Gyógyszerkémiai Kutatócsoportja is részt vesz abban kutatási programban, amely az osztrák Richard Moriggl (Ludwig Boltzmann Rákkutató Intézet és Bécsi Állatorvostudományi Egyetem) vezetésével és Patrick Gunning (Torontói Egyetem) kutatócsoportja közreműködésével a felnőttkori akut leukémiák leggyakrabban jelentkező formája, a csontvelői eredetű vérképző sejteket érintő akut leukémia terápiás lehetőségeinek megújítását tűzte ki célul.
A vérképzőszervi daganatok kialakulásának vizsgálatában 2007-ben sikerült nagyon fontos eredményt elérni:
egy fehérjének (kódnevén JAK2) egy bizonyos mutációját sikerült kimutatni a vérképzőszervi daganatok nagy részében.
Ez azért fontos, mert még a betegség tényleges tünetei előtt, egy gyors vérvizsgálat alapján az esetek több mint 90 százalékában következtetni lehet arra, hogy rákos megbetegedésről van szó.
Ezzel a mutáns fehérjével foglalkozott Peter Sayeski amerikai kutató, amikor megkereste Keserű György Miklósékat, hogy egy általuk kifejlesztett eljárással segítsenek hatékony gátlószert kifejleszteni. Ebben az eljárásban azt használják ki, hogy az egyes fehérjék felületén egyedi barázdák, bemélyedések találhatók, amely barázdákhoz kapcsolódni tudnak egyéb molekulák.
„Mi olyan módszereket fejlesztettünk, amelyek segítik ezen bemélyedések megtalálását, illetve azt próbáljuk megmondani, hogy milyennek kell lennie az adott molekulának ahhoz, hogy egy ilyen bemélyedésbe jól, erősen illeszkedjen"
– mondja Keserű György Miklós.
A legfontosabb cél az volt, hogy sikerüljön egy olyan molekulát találni, amely megfelelően erősen kapcsolódik az adott fehérjéhez, lehetőség szerint úgy, hogy a többi (nem mutáns) fehérjéhez nem képes kapcsolódni, így azokat gátolni sem.
Ekkor kezdődött el az együttműködés Peter Sayeskivel, aki azzal bízta meg a magyar kutatókat, hogy modellezzék az akkor felfedezett fontos fehérje szerkezetét, és próbáljanak egy hozzá jól kapcsolódó molekulát találni. Az amerikai adatbázisban lévő 300 ezer molekulát végigpróbálva találtak 100 olyat, amelyik potenciálisan megfelelő lehetett, amelyből aztán végül 52 darabot sikerült kísérletileg is tesztelni. Ebből az 52-ből találtak végül egyet, amelyikről először sikerült kimutatni, hogy
Mivel ez volt az első olyan molekula, amelyik csak az onkogén, azaz mutálódott fehérje működését gátolta, egy elképesztően hasznos kutatási eszköz lett"
– mondja Miklós. Bár ebből a konkrét molekulából gyógyszer nem készülhetett, de nagyon fontos eszközt adott a tudósok kezébe a további kutatásokhoz.
2015-ben Richard Moriggl, az osztrák Ludwig Boltzmann Rákkutató Intézetből egy pályázat során Sayeski közvetítésével kapcsolatba Keserű György Miklós és Bajusz Dávid csapatával. Morigglék alapvetően egy másik, STAT5 nevű fehérjével foglalkoztak addig alaposabban, ám ez a két fehérje együttesen alkot egy úgynevezett jelátviteli utat: ennek a felső részét képezi JAK2, amellyel a magyar csapat foglalkozott, míg az alsó részt az osztrák csapat vizsgálta. Észrevették, hogy JAK2 korábban felfedezett mutációja jelentősen növeli e fehérje aktivitását a STAT5 fehérjén, amely így egy meghatározó útja az akut mieloid leukémia kialakulásának is.
Ez a fajta leukémia adja a felnőttkori leukémiák egyharmadát, és ez a legrosszabb prognózisú fajta, hiszen az ötéves túlélési arány mindössze 26 százalék.
Az elmúlt három évben így kiterjesztették a Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal felfedező kutatásokat támogató programjában több mint 40 millió forinttal finanszírozott kutatást a STAT5 fehérjére is az ígéretes kutatási tervek miatt.
2018 februárjában a Nature leukémiával foglalkozó szaklapjában megjelent tudományos publikációban az osztrák, magyar és kanadai kutatókból álló csapat
egy új és hatékony STAT5 gátlószer fejlesztéséről számolnak be, amely sikeresen megakadályozta a sejtosztódást és a sejtnövekedést akut mieloid leukémia sejtvonalakon és az akut mieloid leukémia állatmodelljében is.
„Azért volt különösen nehéz dolgunk, mert a STAT5 fehérjén rendkívül kevés és kicsi barázda és bemélyedés található, ezért nagyon nehéz volt megtalálni azt a molekulát, amely megfelelően erősen képes rajta megtapadni." A most kifejlesztett gátlószer azért különösen jó, mert specifikus, azaz a többi – szervezetben fontos szerepet betöltő – STAT és egyéb fehérjéket nem bántja, kizárólag a tumorsejteket pusztítja.
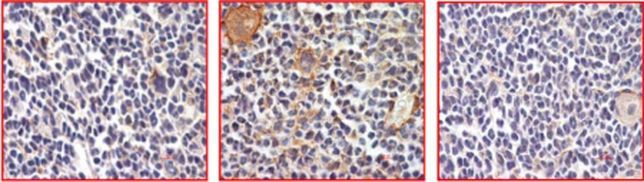
A hatásosságot leukémiás betegekből származó emberi sejteken is sikerült igazolni, és ez nemcsak leukémiákban teremthet új terápiás lehetőséget, hanem a konzorcium reményei szerint
mindazokban a daganatos megbetegedésekben hatékony lehet, amelyekben a STAT jelátvitel meghatározó szerephez jut.
A vegyület közeljövőben induló klinikai fejlesztése és az Ausztriában, Magyarországon és Kanadában tovább folytatódó kutatások várhatóan arra is választ adnak, mely egyéb daganatos betegségekben nyithat új terápiás távlatokat a mostani felfedezés.
A cikk az NKFI Hivatal kutatási témapályázatok programjában támogatást nyert projekt, Nature kiadó szaklapjában publikált eredmény összefoglalója.












