Nem idegesek, mégis kétszázas a vérnyomásuk

A Fekete-tengerhez közeli faluban élő török család már az 1970-es évek elején felkeltette a kutatók figyelmét, miután egy orvos sajátos tünetegyüttest észlelt a körükben. Sokuknak szokatlanul rövidek az ujjai, és
csillagászatian magas a vérnyomásuk: nem ritka, hogy az egészséges érték kétszeresét verdesi.
Ez persze nem a hosszú élet záloga, és az érintetteket rendszerint 50 éves koruk körül éri a végzetes agyvérzés.
Bár a jelenség igen szembetűnő, módszeres tanulmányozásához mégiscsak húsz évvel később látott hozzá a Helmholtz Társasághoz tartozó berlini Max Delbrück Molekuláris Orvostani Központ egyik kutatócsoportja Friedrich Luft professzor és Dr. Sylvia Bähring vezetésével. A rejtély felfejtése azonban nem mutatkozott egyszerű feladatnak, és egészen 2015-ig tartott, mire a kutatók a Nature Genetics folyóiratban végre közölték, melyik gén felelős a HTNB-nek (Hypertension and Brachydactyly, magas vérnyomás és rövid ujjak) elnevezett szindrómáért. A gén mutáns változatát valamennyi érintettben megtalálták. Az örökletes rendellenességet első török leírója után Bilginturan-szindrómaként is ismerik.

A szóban forgó gén a
foszfodiészteráz 3A – röviden PDE3A
– nevű enzimfehérjét kódolja, amely egyaránt szabályozza a csontok növekedését és a vérnyomást. A Luft és kutatócsoportja által felfedezett génmutáció hatására az enzim aktívabb lesz a szokásosnál.
Az viszont még a 2015-ös közléskor sem volt világos, milyen működési mechanizmus kapcsolja össze a PDE3A mutációját a Bilginturan-szindróma jellegzetes tüneteivel. Ugyanezt a génváltozatot – és az általa előidézett kórképet – azóta egyébként világszerte több más családban is azonosították. A PDE3A-mutáció és a betegség kapcsolatának végső bizonyítékát egy 40 kutatóból álló nemzetközi munkacsoport csak most hozta nyilvánosságra a Circulation című folyóirat legutóbbi számában. A németországi Berlinből, Bochumból és Limburgból, valamint a kanadai Torontóból és az új-zélandi Aucklandből összeverbuvált tudóscsapat tagjai között tudja Luft professzort is, a cikk rangidős szerzője pedig a Max Delbrück Központ jelátviteli laboratóriumát irányító Dr. Enno Klußmann.
Elsősorban két állatmodellel dolgoztunk
– mondta el Dr. Markó Lajos, a több mint egy évtizede Berlinben dolgozó magyar kutatóorvos, aki Maria Ercu-val együtt vezető szerepet vállalt a Circulation-cikk megírásában. –
Az egyik modellben a genetikailag módosított egerek az emberi PDE3A enzim túlzottan aktív mutáns változatát hordozzák a simaizomsejtjeikben. Ezeknek az állatoknak a kontrollokhoz képest extrém magas a vérnyomásuk."
A tudósok számára azonban még érdekesebbnek bizonyult az a Michael Bader professzor laboratóriumában létrehozott patkánytörzs, amelyben a CRISPR-Cas9 technológia segítségével átszerkesztették a PDE3A génjét.
A szerkesztés azt a 9 bázispáros ún. mutációs forrópont-régiót érintette, amely a betegséget hordozó családokban mutációt szenvedett.
Az így módosított enzim a normális változattól mindössze 3 aminosavban tér el, funkciója mégis jelentősen módosul. „Az apró változás nyomán az enzim aktivitása lényegesen megnőtt, éppen ahogy az emberi betegekben – fejtette ki Ercu. – A patkányok kórképe csakugyan figyelemre méltó mértékben hasonlított az emberi betegekére.
Nemcsak magas vérnyomásban szenvedtek, de az elülső lábaik ujjai is jelentősen megrövidültek, csakúgy, mint a Bilginturan-szindrómás betegek ujjai."
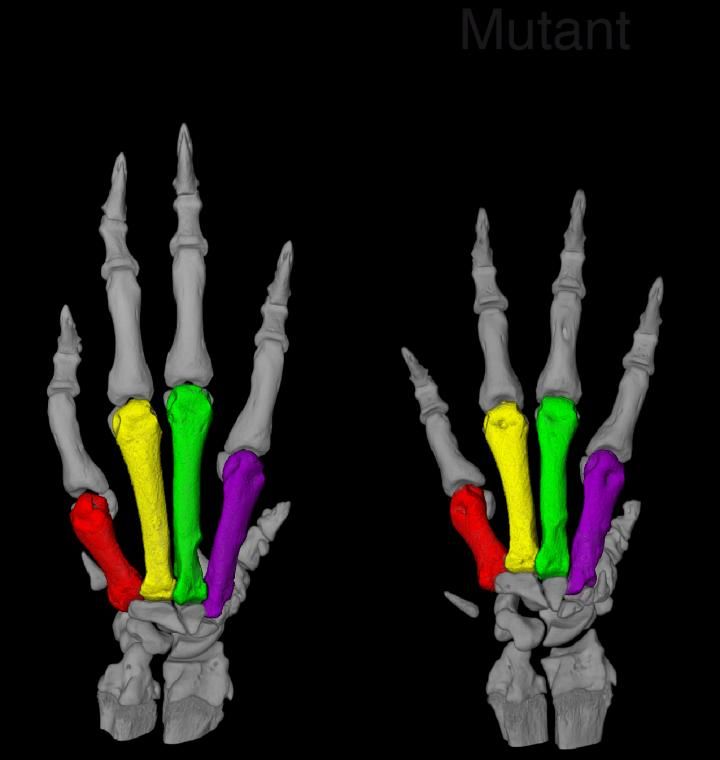
Mikro-komputertomográfiás képalkotással a kutatók rábukkantak egy feltűnő hurokra a patkányok agyi ereiben, amely szintén megtalálható a mutáció által érintett emberekben.
Véleményem szerint a patkánymodell ad végérvényes bizonyítékot arra, hogy a Bilginturan-szindrómát a PDE3A gén mutációja okozza"
– szögezte le Klußmann.
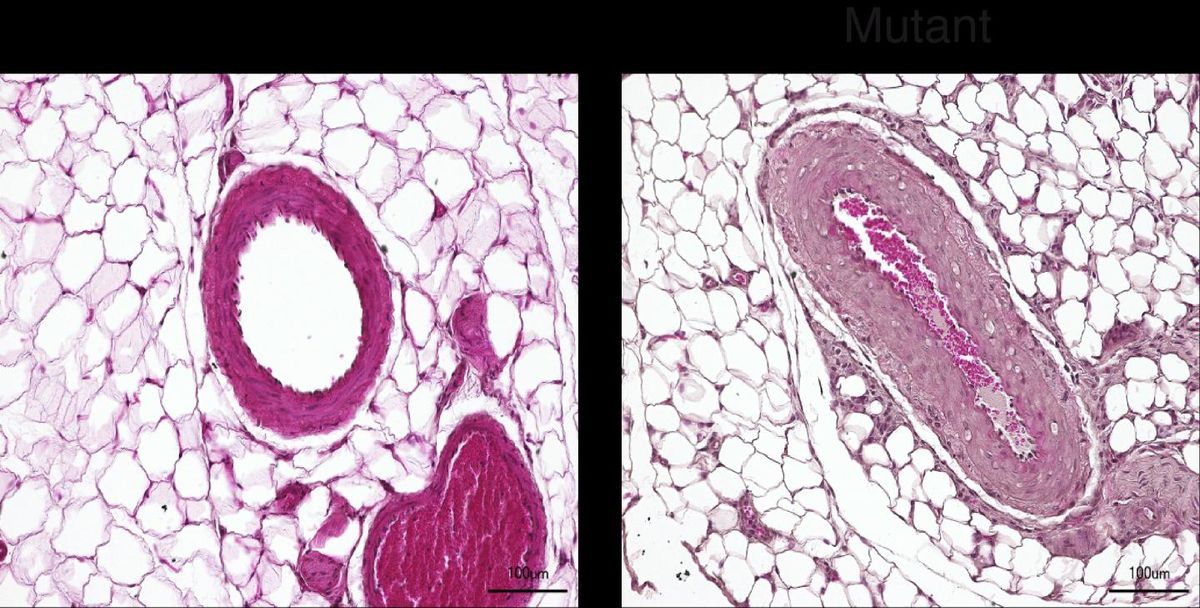
A kutatások célja persze túlmutat az érdekes, de roppant ritka örökletes tünetegyüttes okainak tisztázásán: a valódi tét a népbetegségnek számító közönséges magas vérnyomás hatékonyabb kezelése. A speciális, Bilginturan-féle vérnyomásproblémára már találtak egy lehetséges terápiás megoldást.
A riociguat nevű gyógyszert a hatóságok már befogadták a tüdő-eredetű magas vérnyomás kezelésére
– magyarázza Klußmann. – A riociguat működéséről tudjuk, hogy aktivál egy enzimet, amely egy jelmolekulát termel, s ez végső soron csillapítja a túlzottan aktív PDE3A fehérjét. Amikor a mutáns patkányoknak a riociguat egy származékát adtuk, vérnyomásuk a normális szintre esett." A tudós elmondta: más PDE3A gátlószerek is vannak már a piacon, de ezek mellékhatásaik miatt nem alkalmasak hosszú távú kezelésre.
Klußmann és munkatársai most szeretnék alaposabban megvizsgálni, hogyan kölcsönhat a mutáns PDE3A más fehérjemolekulákkal. Egyes adapterfehérjékkel való túl erős kapcsolódása például kóros szaporodásra késztetheti a véredények belső falát borító sejteket, ami beszűkíti az erek üregét, és megemeli a bennük uralkodó nyomást.
A PDE3A más fehérjékkel való kölcsönhatásainak alaposabb ismeretén keresztül, illetve annak jobb megértésével, hogy e kölcsönhatások hogyan szerepelnek a vérnyomás szabályozásában, remélhetőleg eljutunk a létező legelterjedtebb betegség, a magas vérnyomás új és hatékonyabb kezeléséhez"
– összegezte Klußmann.












