Több ezer kóros fehérjét talált a mesterséges intelligencia
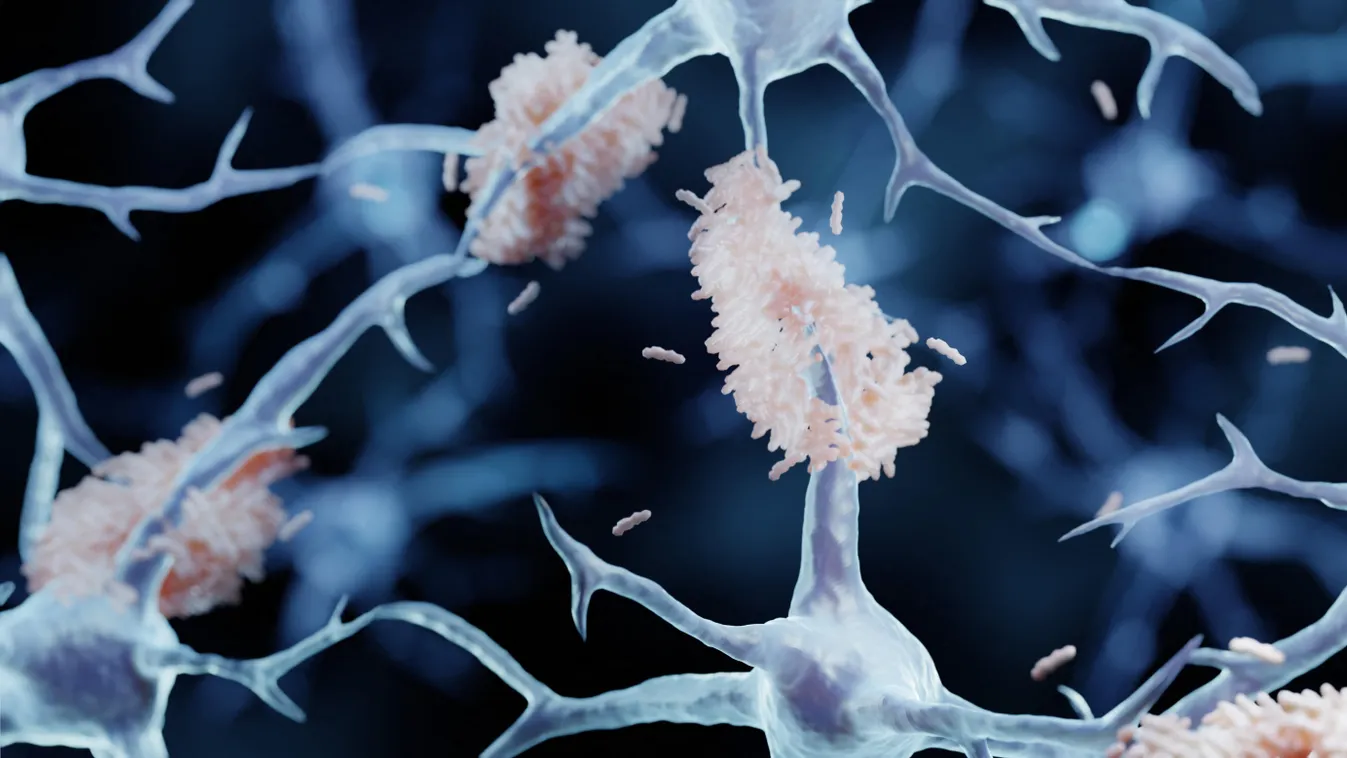

A sejtek belsejében az élet alapjául szolgáló fehérjék oldott formában vannak jelen. Oldhatóságuk térbeli szerkezetükkel van kapcsolatban: ha a térszerkezet megváltozik, a fehérje félretekeredik és oldhatósága is leromlik. Ilyen térszerkezeti változás a fehérje amiloiddá alakulása, ami indikátora vagy oka lehet olyan betegségek kialakulásának, mint az Alzheimer-kór, a Parkinson-kór vagy a Huntington-betegség, illetve a különböző, esetenként öröklődő amiloidózisok - olvasható az ELTE csütörtöki közleményében.
Az ELTE-n, Perczel András Széchenyi-díjas kémikus kutatócsoportjában évtizedek óta vizsgálják egyes peptidek és fehérjék amiloiddá alakulásának folyamatát és feltételeit. A kutatók a közelmúltban az ELTE Matematikai Intézetében működő PIT Bioinformatikai Csoporttal (Keresztes László, Szögi Evelin, Varga Bálint és Grolmusz Vince professzor) Budapest Amiloid Prediktor néven mesterséges intelligencia alapú eszközt hoztak létre. Ez az algoritmus és szerver bármely, hat aminosav hosszúságú peptidre 84 százalékos pontossággal megjósolja, hogy amiloidképző-e vagy sem.
A kutatók magyarázata szerint a hat aminosav hosszú peptidek egyrészt még elég egyszerűek és könnyebben tanulmányozhatók, mint a hosszabb társaik, másrészt már eléggé összetettek ahhoz, hogy az amiloidképződés egyszerű, de hiteles modelljei legyenek. Ilyen peptidekből összesen 206, vagyis 64 millió különböző molekula létezhet, közülük ma még csak alig kétezer amiloidképzési hajlamát írták le a kutatók. A Budapest Amiloid Prediktor a ma még szűk adatmezőre alapozva tesz kellőn megbízható jóslást a lehetőségek teljes tárházáról.
Perczel András és Farkas Viktor a PIT Bioinformatikai Csoporttal legújabb vizsgálatuk során olyan amiloidképzési mintákat azonosítottak, amelyekben adott pozíciókban behelyettesített akármilyen fehérjeépítő aminosavakból várhatóan amiloidképző peptidek lesznek. A Budapest Amiloid Prediktor szerint ilyen erősen amiloidogén mintázatok például a CxFLWx, FxFLFx, vagy az xxIVIV, ahol a nagybetűk egy-egy aminosav egybetűs kódját jelölik, míg az x-ek helyébe bármely tetszőleges aminosav behelyettesíthető. A kutatók összesen 5531 ilyen mintát határoztak meg.
"A kutatók komoly érdeme, hogy szétválasztják azokat a pozíciókat és aminosavakat, amelyek az amiloidképzés szempontjából kiemelten fontosak, és azokat, amelyek nem, amelyek helyére tehát tetszőleges aminosavakat helyettesíthetünk be. Emellett minden minta röviden és érthetően leír 400 hat hosszú peptidet, mivel ennyi lehetséges behelyettesítése lehet a húsz aminosavnak az x-ek helyére" - írták.
Az amiloidmintákat leíró cikk az Amerikai Kémiai Társaság lapjában, az ACS Omega című tudományos folyóiratban jelent meg.












