Barkácsolt herpeszvírussal támadták meg a bőrrákot

A tanulmány, amely az egyik legrangosabb onkológiai folyóiratban, az Amerikai Klinikai Onkológiai Társaság által kiadott Journal of Clinical Oncology-ban látott napvilágot, egy nagyszabású klinikai kipróbálás eredményéről számol be, melyben a talimgogene laherparepvec (T-VEC) névre keresztelt újfajta immunterápiás eljárás hatékonyságát értékelték előrehaladott melanómás betegekben.
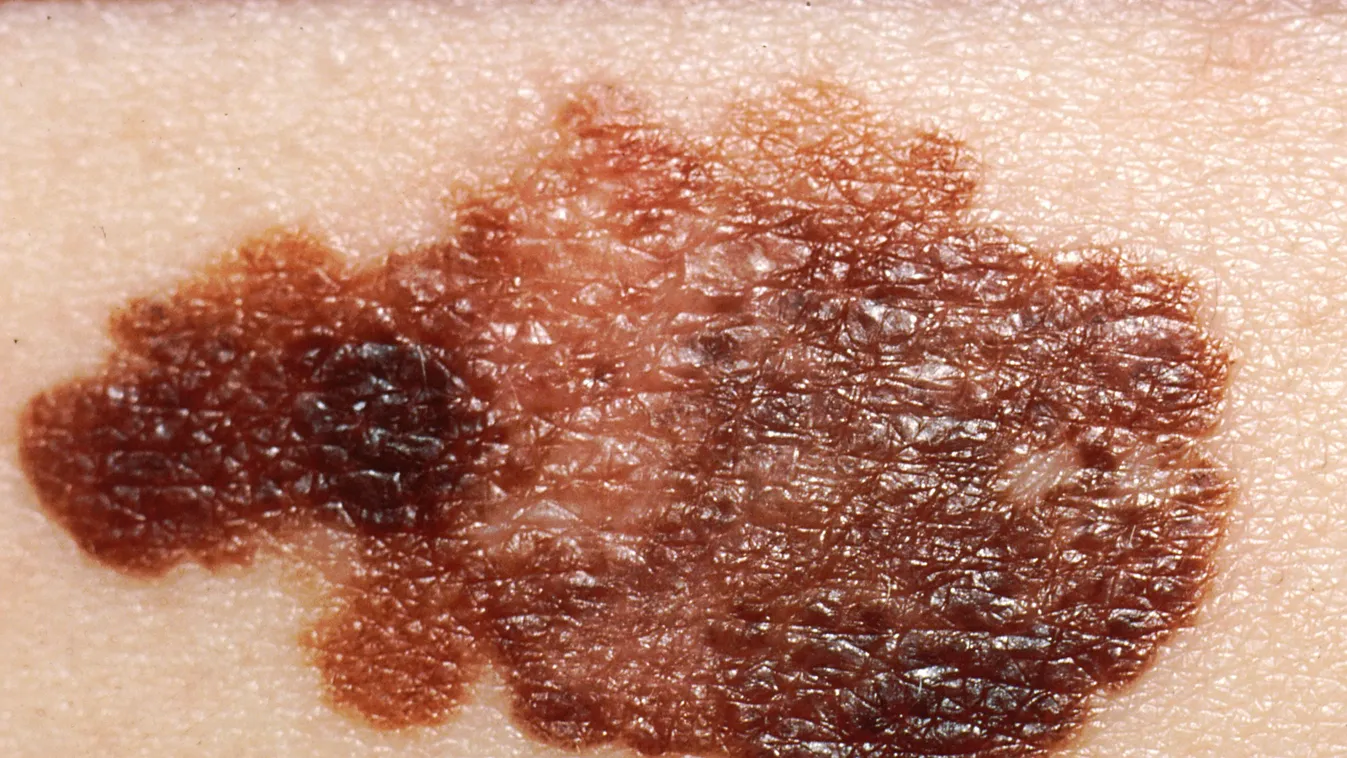
A melanóma a bőr daganatai közül a legveszedelmesebb,mert nagyon korán távoli áttéteket ad,
előrehaladott eseteit pedig műtétileg gyakran már nem lehet kezelni.
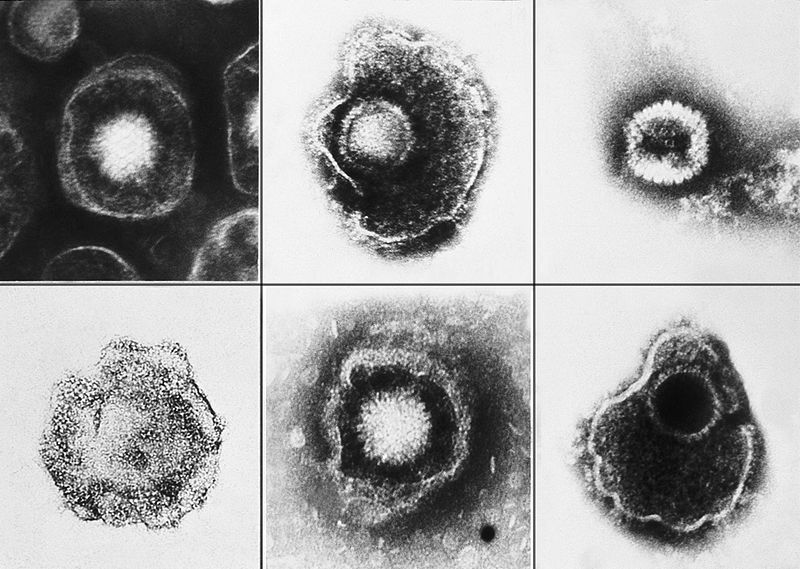
A T-VEC az ajakherpesz kórokozójaként közismert Herpes simplex (HSV-1) vírus módosított származéka.
A készítményt közvetlenül a daganatba fecskendezik, ahol immunválaszt idéz elő,
amely ebben az esetben a tumor ellen irányul. A daganatba juttatott T-VEC elsősorban azáltal hívja életre a védekező választ, hogy helyileg beindítja a granulocita-makrofág kolóniastimuláló faktor (GM-CSF) nevű jelmolekula termelését.
Úgy tűnik azonban, hogy a víruskészítmény ezen felül is tartogat még valamilyen extra trükköt, mivel a kísérlet kontrollágán a betegeknek T-VEC helyett rögtön GM-CSF-et adtak, és ez utóbbi távolról sem bizonyult olyan hatékonynak. A daganat helyén a bőr alá adott GM-CSF injekciókra csak a daganatok 2,1 százaléka reagált kedvezően 6 hónapnál hosszabb ideig, míg a
T-VEC esetében ez az arány elérte a 16,3 százalékot.
A betegek életkilátásaira ugyanakkor csak minimális hatással bírt a kezelés: a T-VEC ágon 23,3 hónap volt az átlagos túlélés, szemben a GM-CSF ágon mért 18,9 hónappal.
Amint az ebből az adatból is kiderül, az előrehaladott melanóma gyógyításáról beszélni egyelőre korai lenne.
A T-VEC mértékadó vélemények – például a brit Nemzeti Egészségügyi Szolgálat (National Health Service, NHS) értékelői – szerint is ígéretes próbálkozás, de egyelőre nem világos, hatékonysága hogyan viszonyul a már bevett kezelésekéhez, és az is tisztázásra vár, hogy vajon más daganattípusok terápiájában is alkalmazható-e a készítmény.
A klinikai kísérletet több nagy észak-amerikai intézmény összefogásával végezték; a szervezők között szerepelt a Utahi Egyetem és a New Jersey-i Rákkutató Intézet. Az anyagi hátteret a technológia kifejlesztéséért felelős Amgen gyógyszeripari óriás biztosította.
A kísérlet Észak-Amerika, az Egyesült Királyság és Dél-Afrika számos pontján, összesen 64 helyszínen zajlott egyszerre,
és 436 olyan felnőtt páciens vett benne részt, akiknél a műtéti megoldás már nem jöhetett szóba.
A készítmény működéséről annyit érdemes tudni, hogy az ajakherpeszt okozó HSV-1 vírust olyan módosításoknak vetették alá, melyek következtében kitüntetett módon csak a daganatban szaporodik, és ott megindítja a GM-CSF termelését.
Ez a jelmolekula azon kívül, hogy a csontvelőben a fehérvérsejt-képzés egyik kulcsfontosságú serkentője, a természetes immunválasz kialakításában is fontos szerepet játszik.
Normális esetben fehérvérsejtek termelik akkor, ha kórokozót vagy abnormális sejteket észlelnek, és hatására további fehérvérsejtek sereglenek a baj gócpontjába. A daganatban termelődő GM-CSF-től ezért azt várták, hogy fehérvérsejteket vonz a helyszínre, amelyek felerősítik a szervezet természetes tumorellenes immunválaszát.
Ezt a várakozást igazolták is az eredmények: azok a betegek, akik a véletlenszerű kiválasztás során a T-VEC kezelésben részesülők közé kerültek, csaknem 9-szer nagyobb eséllyel válaszoltak pozitívan a kezelésre, mint a GM-CSF-et kapó kontrollok.
A T-VEC-re jól reagáló daganatokat hosszabb ideig is sikerült féken tartani:
a T-VEC kezelés átlagosan 8,2 hónap után mondott csődöt (az előrehaladott melanómák esetében egyelőre előbb-utóbb minden kezelés csődöt mond), míg a GM-CSF átlagban csak 2,9 hónapig tudta hátráltatni a daganat rosszabbodását.
Mindezen előnyök mellett a T-VEC mellékhatásai is elviselhetőnek tűntek. A leggyakoribb nemkívánatos hatás a láz volt, amely a T-VEC-kel kezeltek felében jelentkezett, míg a GM-CSF csak a betegek kevesebb mint 10 százalékában váltott ki magas lázat.
A brit NHS kommentátorai – anélkül, hogy vitatnák az új immunterápiás eljárásban rejlő potenciált – néhány megjegyzést fűznek a kísérlethez. Rámutatnak, hogy a T-VEC-et célszerűbb lenne a melanóma kezelésére elfogadott, és ma legjobbnak tartott terápiás eljárásokkal összevetni.
A GM-CSF-kezelés, noha egyes daganatkezelési protokollokban alkalmazzák az immunrendszer erősítésére, jelenleg nem szerepel a melanóma kezelési palettáján; kontrollként való kiválasztását ez esetben a T-VEC működési mechanizmusa indokolta, amennyiben a víruskészítmény vélhetőleg (bár valószínűleg nem kizárólagosan) a GM-CSF termelésén keresztül fejti ki kedvező hatását.
A kritika azonban azt sugallja, hogy a melanóma ellen napjainkban alkalmazott
kemoterápia, sugárterápia, de különösen a már bevett immunterápiák, például az ipilimumab nevű ellenanyag
megfelelőbb kontroll lenne annak megállapításához, hogy a T-VEC vajon felülmúlja-e a ma legjobbnak gondolt kezelések hatékonyságát.
Az NHS kommentárja arra is felhívja a figyelmet, hogy a melanóma gyógyítását hirdető szalagcímek félrevezetőek, ugyanis a T-VEC-re csak
átlagosan minden ötödik beteg reagált,
tehát ettől a kezeléstől sem várható, hogy mindenkinek egyformán használ majd. A szakértők óva intenek attól a téves értelmezéstől is, hogy a természetes herpeszvírussal való fertőződés bármiféle védettséget nyújtana a melanómával szemben.
A T-VEC az ajakherpesz vírusának genetikailag módosított származéka, amely kimondottan daganatellenes sajátságokkal lett felruházva. Az eredeti herpeszvírus semmiféle melanómaölő képességgel nem rendelkezik; nehogy azt gondolja tehát valaki, hogy egy ajakherpesz beszerzése után bármennyi korlátlan és felelőtlen napozás biztonságosan megengedhető.












